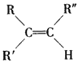
-
在稳定人体血液的pH中起作用的离子是
A.Na+ B.HCO3- C.Fe2+ D.Cl-
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆 B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂 D.Al2O3熔点高,可用作耐高温材料
难度: 简单查看答案及解析
-
下列各组物质充分反应后,滴入KSCN溶液一定显红色的是( )
A.FeO加入稀硝酸中 B.FeCl3、CuCl2溶液中加入过量的铁粉
C.生了锈的铁块加入稀硫酸中 D.Fe加入稀硝酸中
难度: 简单查看答案及解析
-
除去物质中含少量杂质的方法错误是
选项
物质(括号内为杂质)
实验方法
A
K2SO4 (K2CO3)
加入稀硫酸使溶液呈中性
B
NaCl (KNO3)
样品配制成热饱和溶液,冷却结晶,过滤
C
CO2(HCl)
通过NaHCO3饱和溶液,干燥
D
溴苯(溴)
加入足量NaOH溶液,充分振荡,分液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.N原子的轨道表示式:

B.氧化钠的分子式:Na2O
C.碳-14原子表示为:14C
D.Na2S的电子式:
难度: 简单查看答案及解析
-
能用键能大小解释的事实是
A.稀有气体化学性质很稳定 B.硝酸易挥发,而硫酸难挥发
C.氮气的化学性质比氧气稳定 D.常温常压下,溴呈液态,碘呈固态
难度: 中等查看答案及解析
-
有机物命名正确的是( )
A.CH2BrCH2Br 二溴乙烷
B.CH3OOCCH3 甲酸乙酯
C.
2-乙基丙烷
D.
3,3-二甲基-2-丁醇
难度: 简单查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是
A.用蒸馏水冼净滴定管后,装入标准盐酸进行滴定
B.用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液
C.用甲基橙做指示剂,当溶液由黄色变成橙色,立刻读数盐酸体积
D.用碱式滴定管取10.00 mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,加入适量蒸馏水后再进行滴定
难度: 中等查看答案及解析
-
能够说明硫的非金属性比氯弱的事实有
①
与铁反应生成
,S与铁反应生成FeS
②
和
的混合气,经强光照射可剧烈反应,而S与
反应需较高温度
③将
通入氢硫酸中可置换出硫
④常温时硫单质为固态而氯单质为气态.
A.①③ B.①②③ C.②④ D.①②③④
难度: 简单查看答案及解析
-
室温下,2H2(g)+O2(g)
2H2O(l)+566kJ。下列说法错误的是
A.H2
H+H的过程需要吸热
B.若生成2mol水蒸气,则放出的热量大于566kJ
C.2g氢气完全燃烧生成液态水所释放的能量为283kJ
D.2mol氢气与1mol氧气的能量之和大于2mol液态水的能量
难度: 中等查看答案及解析
-
在2L密闭容器中充入lmolO2和2molSO2,在一定条件下发生下列反应2SO2(g)+O2(g)⇌2SO3(g)+Q,5min后测得O2减少了0.1mol。下列说法正确的是( )
A.此反应的平均速率v=0.01mol/(L·min)
B.升高温度,正反应增加的速率一定小于逆反应增加的速率
C.如果不断的加入SO2,最终O2会全部反应完
D.其他条件不变,密闭容器体积改为1L,5min后测得O2减少的量一定大于0.1mol
难度: 中等查看答案及解析
-
下列事实中不能用勒夏特列原理解释的是( )
A.久置的氯水pH值变小
B.向稀盐酸中加入少量蒸馏水,溶液中氢离子浓度降低
C.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率
D.工业生产硫酸过程中使用过量的空气以提高二氧化硫的利用率
难度: 简单查看答案及解析
-
X、Y、Z、W为四种短周期非金属元素,其中X单质是一种重要的半导体材料, X、Y、Z同周期,且原子序数依次增大,Y、W同主族,离子半径Y2->W2-。
下列说法正确的是:
A.X的非金属性比Y的强
B.X和W组成的化合物化学性质活泼,与盐酸和氢氧化钠溶液都能反应
C.Y的气态氢化物不如Z的气态氢化物稳定
D.某溶液中通入Z的单质后再滴加淀粉溶液显蓝色,原溶液中一定含有I-
难度: 中等查看答案及解析
-
如图所示电化学装置,X可能为“锌棒”或“碳棒”,下列叙述错误的是

A.X为锌棒,仅闭合K1,Fe电极上发生还原反应
B.X为锌棒,仅闭合K1,产生微量电流方向:Fe→X
C.X为碳棒,仅闭合K2,该电化学保护法称为“牺牲阳极阴极保护法”
D.若X为碳棒,仅闭合K1,铁电极的极反应为:Fe -2e-→ Fe2+
难度: 中等查看答案及解析
-
橙花醇可作为香料,其结构简式如图:
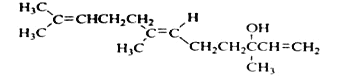
关于橙花醇叙述错误的是
A.可使酸性 KMnO4溶液褪色
B.橙花醇中含有2种官能团
C.在浓硫酸催化下加热脱水,生成的产物不止一种
D.1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴
难度: 中等查看答案及解析
-
某溶液中可能存在Fe3+、Fe2+、I−、HCO3-、Cl−、NO3-六种离子中的几种。现进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈血红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深。
据此可以推断,该溶液中肯定不存在的离子是( )
A.I−、HCO3-、Cl−
B.Fe2+、HCO3-、NO3-
C.I−、HCO3-
D.Fe3+、I−、HCO3-
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,17g甲基(—14CH3)所含的中子数为9NA
B.pH=1的稀硫酸中含有的H+ 数为0.1NA
C.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
D.常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA
难度: 中等查看答案及解析
-
室温时,等体积、浓度均为0.1mol/L的下列水溶液,分别达到平衡。
①醋酸溶液:CH3COOH⇌CH3COO+H+
②醋酸钠溶液:CH3COO−+H2O⇌CH3COOH+OH−
有关叙述中正确的是( )
A.加入等体积水后,只有②中平衡向右移动
B.加入等体积水后,①中c(OH−)增大,②中c(OH−)减小
C.①和②中,由水电离出的c(H+)相等
D.c(CH3COOH)与c(CH3COO−)之和:①>②
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.石灰乳与碳酸钠溶液混合:Ca2++CO32-=CaCO3↓
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液,刚好沉淀完全:Ba2+ +2OH-+2H++SO42-=BaSO4↓+2H2O
C.向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO3-=3BaSO4↓+2NO↑+H2O
D.碳酸氢钠溶液中加入过量的氢氧化钙溶液:2HCO3- + Ca2+ + 2OH-=CaCO3↓+ 2H2O + CO32-
难度: 中等查看答案及解析
-
将8.985g 含少量氯化钠的碳酸氢钠固体加热一段时间,再加入足量盐酸完全反应。有关叙述正确的是
A.固体分解越完全,消耗盐酸的量越少
B.共生成0.1mol二氧化碳,固体中氯化钠为5.85g
C.固体中碳酸氢钠含量越多,钠元素的含量也越多
D.溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g
难度: 中等查看答案及解析