-
短周期元素W、X、Y和Z的原子序数依次增大,W的单质是一种常用的比能量高的金属电极材料,X原子的最外层电子数是内层电子数的2倍,元素Y的族序数等于其周期序数,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A. W、Z形成的化合物中,各原子最外层均达到8个电子结构
B. 元素X与氢形成的原子数之比为1∶1的化合物有很多种
C. 元素Z可与元素X形成共价化合物XZ2
D. 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
难度: 中等查看答案及解析
-
化学与科学技术、环境、人类生活密切相关。下列说法错误的是
A.保持室内空气流通是最简单、最有效减少室内空气污染的方法
B.航天飞船中使用的碳纤维,是一种新型的无机非金属材料
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.用可降解的无毒聚乳酸塑料代替聚乙烯作食品包装袋,可防止白色污染
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 25℃,pH=1的H2SO4溶液中,H+的数目为0.2NA
B. 常温常压下,56g丙烯与环丁烷的混合气体中含有4NA个碳原子
C. 标准状况下,11.2LCHCl3中含有的原子数目为2.5NA
D. 常温下,1mol浓硝酸与足量Al反应,转移电子数为3NA
难度: 中等查看答案及解析
-
关于有机化合物对甲基苯甲醛(
),下列说法错误的是
A. 其分子式为C8H8O
B. 含苯环且有醛基的同分异构体(含本身)共有4种
C. 分子中所有碳原子均在同一平面上
D. 该物质不能与新制的Cu(OH)2悬浊液反应
难度: 中等查看答案及解析
-
某实验小组模拟光合作用,采用电解CO2和H2O的方法制备CH3CH2OH和O2装置如图所示。下列说法不正确的是
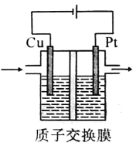
A. 铂极为阳极,发生氧化反应
B. 电解过程中,H+由交换膜左侧向右侧迁移
C. 阴极的电极反应式为2CO2+12H++12e-====CH3CH2OH+3H2O
D. 电路上转移2mol电子时铂极产生11.2LO2(标准状况)
难度: 中等查看答案及解析
-
下列实验对应的现象以及结论均正确的是
选项
实验
现象
结论
A
向装有溴水的分液漏斗中加入裂化汽油,充分振荡,静置
下层为橙色
裂化汽油可萃取溴
B
向Ba(ClO)2溶液中通入SO2
有白色沉淀生成
酸性:H2SO3>HClO
C
分别向相同浓度的ZnSO4溶液和CuSO4溶液中通入H2S
前者无现象,后者有黑色沉淀生成
Ksp(ZnS)>Ksp(CuS)
D
向鸡蛋清溶液中滴加饱和
Na2SO4溶液
有白色不溶物析出
Na2SO4能使蛋白质变性
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HC1溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
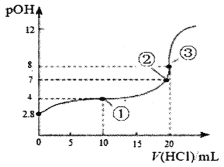
A.图中②点所示溶液的导电能力弱于①点
B.③点处水电离出的c(H+)=1×10-8mol·L-1
C.图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+)
D.25℃时氨水的Kb约为5×10-5.6mo1·L-1
难度: 困难查看答案及解析


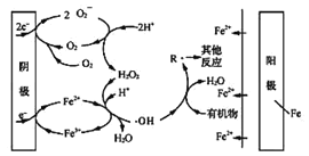

 )的同分异构体有______种,写出其中一种同分异构体的结构简式:_________________ 。
)的同分异构体有______种,写出其中一种同分异构体的结构简式:_________________ 。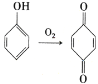 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(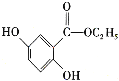 )的合成路线(无机试剂任用):________。
)的合成路线(无机试剂任用):________。