-
2019 年上海、西安等城市先后开始实施生活垃圾分类,分类的目的是提高垃圾的资源价值和经济价值,力争物尽其用,垃圾是放错地方的资源,同时也是建立环境友好型国家的重要举措。下列关于垃圾分类的说法正确的是
A.废电池、过期药品属于有害垃圾,无需回收,为防止污染环境应当深埋处理
B.其它垃圾包括防新型冠状病毒用的口罩、烟头等物品无法利用,应当弃去不要
C.废纸类、废塑料、废玻璃、废金属、废油漆桶等属于可回收物
D.厨余垃圾经生化处理转化为沼气和有机肥料,从而生产绿色有机食品和清洁燃料
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法中不正确的是
A. 标准状况下,22.4LCl2通入足量NaOH溶液中,完全反应时转移的电子数为2NA
B. 20gD2O含有的电子数为10NA
C. 1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA
D. 25℃时,1.0LpH=12的NaClO溶液中由水电离出OH-的数目为0.01NA
难度: 中等查看答案及解析
-
甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是
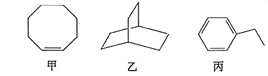
A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
已知 A、B、C、D、E 是短周期中原子序数依次增大的五种元素,A、B 形成的简单化合物常用作制冷剂,D 原子最外层电子数与最内层电子数相等,化合物 DC 中两种离子的电子层结构相同,A、B、C、D 的原子序数之和是 E 的两倍。下列说法正确的是( )
A.原子半径:C>B>A
B.气态氢化物的热稳定性:E>C
C.最高价氧化对应的水化物的酸性:B>E
D.化合物 DC 与 EC2 中化学键类型相同
难度: 简单查看答案及解析
-
海洋是一个巨大的资源宝库,海水开发利用的部分过程如图所示。下列有关说法不正确的是( )
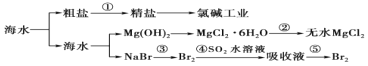
A.①粗盐制精盐除采用过滤泥沙外,还必须除去 Ca2+、Mg2+、SO42-等杂质
B.工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤
C.第②步的反应是将 MgCl2•6H2O 晶体在空气中直接加热脱去结晶水得无水 MgCl2
D.第③步到第⑤步空气吹出法提取海水中溴通常使用 SO2 作还原剂
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得出的结论错误的是( )
选项
操作
现象
结论
A
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体
浓硫酸具有脱水性和强氧化性
B
向 KCl、KI 的混合液中逐滴滴加稀 AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
C
铝片先用砂纸打磨,再加入到浓硝酸中
无明显现象
浓硝酸具有强氧化性,常温下,铝表面被浓硝酸氧化为致密的氧化铝薄膜
D
向盛有 H2O2 溶液的试管中加入几滴酸化的硫酸亚铁溶液
溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成
Fe3+催化 H2O2 分解产生 O2
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
常温下,在10mL0.1mol·L−1 Na2CO3溶液中逐滴加入0.1mol·L−1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示,下列说法不正确的是
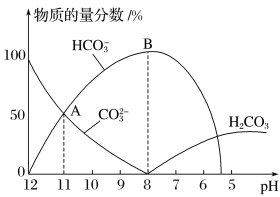
A.溶液的pH为7时,溶液的总体积大于20mL
B.在B点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)
C.在A点所示的溶液中:c(Na+)=c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.已知CO32-水解常数为2×10-4,当溶液中c(HCO3-)=2c(CO32-)时,溶液的pH=10
难度: 困难查看答案及解析
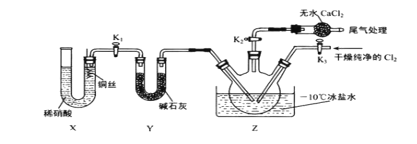
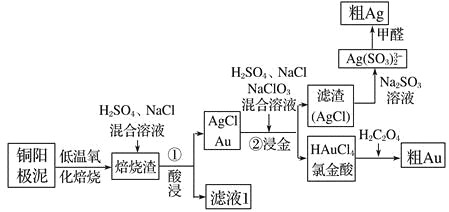
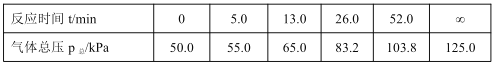
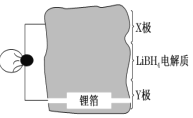
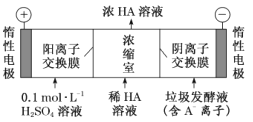

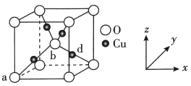
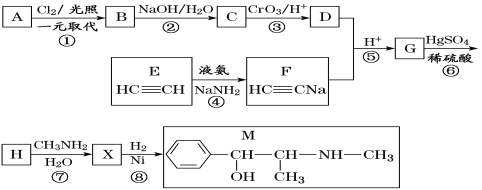
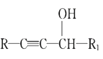
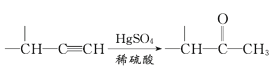

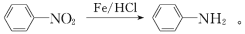 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体