-
中国古代文物不仅彰显了民族和文化自信,还蕴含许多化学知识。下列说法不正确的是
A.商代“四羊方尊”是青铜制品,青铜属于铜的合金
B.宋代《莲塘乳鸭图》所用宣纸,其主要成分是纤维素
C.清代“瓷母”是指各种釉彩大瓶,主要成分是二氧化硅
D.东晋《洛神赋图》中的颜料铜绿,主要成分属于盐类
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法正确的是
A.1 L0.1 mol·L-1NaClO溶液中,阳离子数目为0.1NA
B.1molFe与32gS充分反应,转移的电子数目为2NA
C.1.12 L由NO2和CO2组成的混合气体中含氧原子数目为0.1NA
D.1molN2与足量的H2充分反应,生成N—H键的数目为6NA
难度: 中等查看答案及解析
-
使用催化剂CoGas可选择性实现氢气还原肉桂醛生成肉桂醇,机理如图,下列说法正确的是
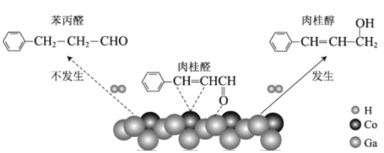
A.肉桂醛分子中所有原子一定不共面
B.苯丙醛分子中苯环上的二氯代物有6种(不含立体异构)
C.可用酸性高锰酸钾溶液鉴别肉桂醛和肉桂醇
D.苯丙醛与
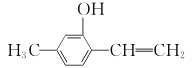 互为同系物
互为同系物难度: 中等查看答案及解析
-
如图为流动电池,其电解质溶液可在电池外部流动,调节电解质,可维持电池内部电解质溶液浓度稳定。下列关于该电池的说法错误的是
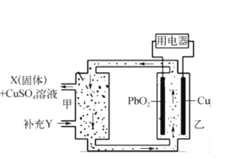
A.Cu为该电池的负极
B.X为PbSO4,Y为H2SO4
C.当消耗1 mol PbO2,需分离出320 g CuSO4
D.PbO2电极反应式为PbO2+4H+ + SO42- +2e-=PbSO4+2H2O
难度: 中等查看答案及解析
-
下列实验现象与实验操作相匹配的是
选项
实验操作
实验现象
A
向盛有溴水的试管中通入足量的乙烯后静置
溶液的棕黄色逐渐褪去,静置后溶液不分层
B
将镁条点然后迅速伸入集满二氧化碳的集气瓶
集气瓶内冒浓烟,生成白色固定粉末和黑色颗粒
C
向盛有饱和Na2S2O3溶液的试管中滴加稀硫酸
有刺激性气味气体产生,溶液仍然澄清
D
向盛有FeCl3溶液的试管中加过量镁粉,充分振荡后加1滴铁氰化钾(与亚铁离子反应成蓝色沉淀)溶液
黄色逐渐消失,加铁氰化钾溶液后,生成蓝色沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X、Y、Z、R是四种原子序数依次增大的短周期主族元素,X和Z位于同主族且能组成离子化合物; Y原子最外层电子数等于其电子层数的3倍;Y的简单阴离子和Z的阳离子的电子层结构相同;R的周期数等于其主族序数。下列说法不正确的是
A.原子半径大小:Z>R>Y>X
B.常温常压下,X与Y形成的化合物呈液态
C.X分别与Y、Z、R组成的二元化合物所含化学键类型均相同
D.R的单质能从硫酸铜溶液中置换出铜
难度: 中等查看答案及解析
-
25 ℃时,用0.100 0 mol·L-1的NaOH溶液滴定20 mL0.1000 mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是
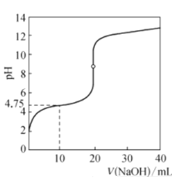
A.可用甲基橙溶液作该滴定过程的指示剂
B.当溶液中由水电离出的c水(OH-)=1×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+)
C.当滴定到pH=4.75时,溶液中:c(Na+ )>c(A-)=c(HA)>c(OH- )
D.当滴入40 mL NaOH溶液时,溶液中:c(Na+)>c(OH-)>c(A-)>c(H+)
难度: 中等查看答案及解析
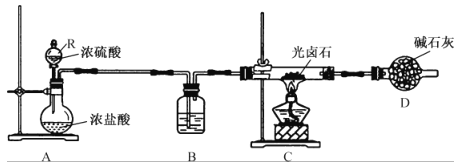
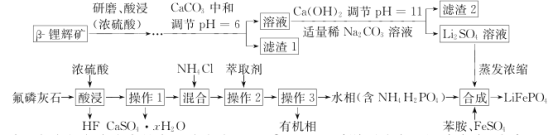
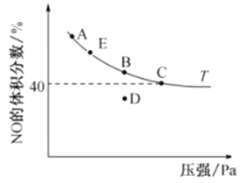
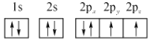 B.
B.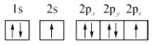
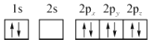 D.
D.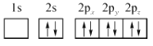

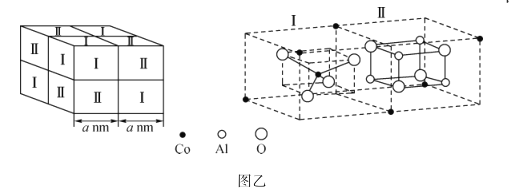
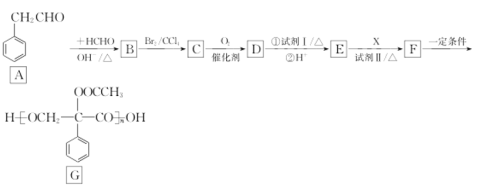
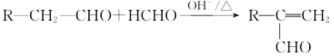
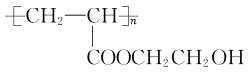 的路线:_______________________________(其他无机试剂任用)。
的路线:_______________________________(其他无机试剂任用)。