-
新型冠状病毒引发的肺炎疫情是2020年最大的公共卫生事件。下列关于新冠肺炎及其防治措施正确的是( )
A.新冠病毒害怕酒精是因为酒精能使蛋白质失去生理活性
B.聚丙烯是制造口罩的原料,聚丙烯能使酸性高锰酸钾溶液褪色
C.双氧水不能用于家庭消毒以预防新冠肺炎
D.抗病毒疫苗可以在高温下贮运
难度: 中等查看答案及解析
-
莽草酸可用于合成药物达菲,其结构简式如图所示。下列关于莽草酸的说法正确的是( )
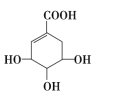
A.分子中所有碳原子共平面
B.分子式为C7H10O5,属于芳香族化合物
C.分子中含有3种官能团,能发生加成、氧化、取代反应
D.1mol莽草酸与足量的NaHCO3溶液反应可放出4molCO2气体
难度: 中等查看答案及解析
-
实验室制备硝基苯的反应装置如图所示。下列实验操作或叙述不正确的是( )

A.试剂加入顺序:先加浓硝酸,再加浓硫酸,最后加入苯
B.实验时水浴温度需控制在50~60℃
C.仪器a的作用:冷凝回流苯和硝酸,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.12g金刚石与12g石墨所含共价键数均为2NA
B.常温下,lLpH=7的1mol/LHCOONH4溶液中HCOO-与NH4+数目均为NA
C.0.1molCl2与0.2molCH4光照充分反应生成HCl分子数为0.1NA
D.100g34%的H2O2中加入MnO2充分反应转移电子数为2NA
难度: 中等查看答案及解析
-
2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的反应式为LixC6+Li1-xCoO2
C6+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是( )
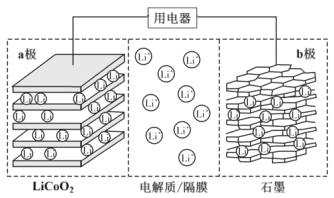
A.放电时,Li+由b极向a极迁移
B.放电时,若转移0.02mol电子,石墨电极将减重0.14g
C.充电时,a极接外电源的正极
D.该废旧电池进行“充电处理”有利于锂在LiCoO2极回收
难度: 中等查看答案及解析
-
五种短周期元素T、W、X、Y、Z的原子序数依次增大。T的一种核素在考古时常用来鉴定一些文物的年代,W的简单气态氢化物遇Z的氢化物产生白烟。T、Z原子最外层电子数之和等于X的核外电子总数,T和Y位于同一主族。下列推断正确的是( )
A.原子半径:T<W<Z<Y<X
B.简单气态氢化物的热稳定性:Y>T>W
C.氧化物对应水化物的酸性:Y<T<W<Z
D.X3W和XW3都是离子化合物,但所含化学键类型不完全相同
难度: 中等查看答案及解析
-
测定溶液电导率的变化是定量研究电解质在溶液中反应规律的一种方法,溶液电导率越大其导电能力越强。室温下,用0.100mol•L-1的NH3•H2O滴定10.00mL浓度均为0.100mol•L-1HCl和CH3COOH的混合溶液,所得电导率曲线如图所示。下列说法正确的是( )
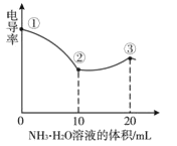
A.①点溶液:pH最大
B.溶液温度:①高于②
C.③点溶液中:c(Cl-)>c(CH3COO-)
D.②点溶液中:c(NH4+)+c(NH3•H2O)>c(CH3COOH)+c(CH3COO-)
难度: 困难查看答案及解析






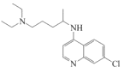 )和磷酸在一定条件下制得。氯喹的合成路线如图:
)和磷酸在一定条件下制得。氯喹的合成路线如图: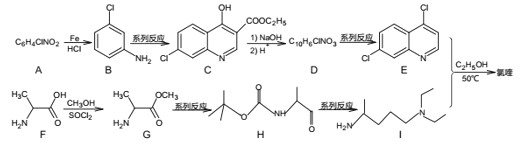
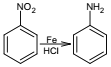 ;③
;③