-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A.
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B.
将铜粉加1.0mol·L-1 Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C.
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D.
将0.1mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1 CuSO4溶液
先有白色沉淀生成后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
《本草经集注》记载:“鸡屎矾(碱式硫酸铜或碱式碳酸铜)不入药用,惟堪镀作,以合熟铜;投苦酒(醋)中,涂铁皆作铜色,外虽铜色,内质不变”。下列说法错误的是
A.鸡屎矾中主要成分属于碱式盐
B.碱式碳酸铜不稳定,受热易分解
C.“涂铁皆作铜色”发生反应为置换反应
D.“内质不变”说明出现了钝化现象。
难度: 中等查看答案及解析
-
下列有关金属及其化合物的应用不合理的是( )
A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
B.铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.无水CoCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
难度: 中等查看答案及解析
-
下列化合物中不能由单质直接化合而制得的是( )
A.FeS B.SO2 C.CuS D.FeCl3
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,当得到标准状况下6.72LCl2时,反应中转移的电子数为0.6NA
B.50ml18.4mol/L的浓H2SO4与足量铜反应,生成SO2的分子数小于0.46NA
C.2.7gAl分别与100ml2mol/L的HCl和NaOH溶液充分反应,转移电子数均为0.3NA
D.含有4.6g钠元素的过氧化钠和氧化钠的混合物中含有离子的总数为0.2NA
难度: 中等查看答案及解析
-
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,有白色沉淀生成,继续滴加沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A.Al2(SO4)3 B.FeSO4 C.BaCl2 D.NaOH
难度: 中等查看答案及解析
-
常温下,下列各组离子在溶液中能够大量共存,且若溶液中c(H+)=10-1mol·L-1有气体产生;若溶液中c(H+)=10-13mol·L-1又有沉淀生成,该组离子可能是( )
A.NH4+、Cl-、SO42-、Mg2+
B.Na+、Al3+、NO3-、CO32-
C.Ba2+、K+、Cl-、NO3-
D.Fe2+、Na+、SO42-、NO3-
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.含0.1molFeI2的溶液中通入0.125molCl2:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
B.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
Fe3++3NO2↑+3H2O
C.Cu溶于稀HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
D.氢氧化铁中加入过量氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
难度: 中等查看答案及解析
-
用下列装置进行有关实验不能达到预期目的的是
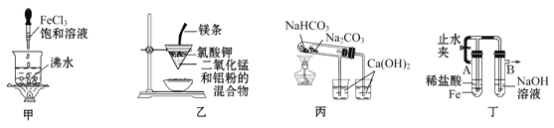
A.用甲装置可制得Fe(OH)3胶体
B.用乙装置可制得金属锰
C.用丙装置验证NaHCO3和Na2CO3的热稳定性
D.用丁装置能较长时间观察到Fe(OH)2白色沉淀
难度: 中等查看答案及解析
-
将一定的
、
合金置于水中,结果合金完全溶解,得到20mL、pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中
的物质的量( )
A.0.01mol B.0.02mol C.0.03mol D.0.04mol
难度: 中等查看答案及解析
-
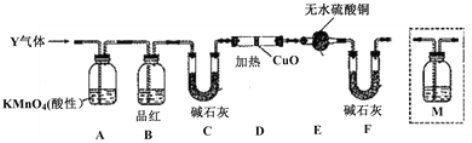
用下图装置制取、提纯、并收集下表中的四种气体
、b、c表示相应仪器中加入的试剂
,其中可行的是
气体
a
b
c
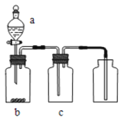
A
浓硝酸
铜片
NaOH溶液
B
浓盐酸
饱和食盐水
C
稀硫酸
浓硫酸
D
浓氨水
生石灰
碱石灰
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列除去杂质的方法正确的是( )
A.除去CO2中少量的SO2气体:将气体通过饱和碳酸钠溶液
B.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后静置
C.除去Al(OH)3中少量的Mg(OH)2:加入稍过量NaOH溶液充分反应后过滤
D.除去NO气体中少量的NO2:将气体通过NaOH溶液
难度: 中等查看答案及解析
-
某同学采用硫铁矿焙烧取取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如图流程:
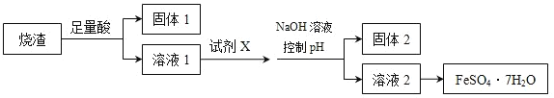
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离可得到FeSO4·7H2O
难度: 中等查看答案及解析
-
下列操作、现象与结论对应关系正确的是( )
操作、现象
结论
A
向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
溶液中一定有SO32-
B
将SO2通入酸性KMnO4溶液中,溶液褪色
SO2有漂白性
C
向某溶液中加入NaOH溶液,将湿润的蓝色石蕊试纸放在试管口,试纸不变色
溶液中一定没有NH4+
D
某溶液中加入KSCN,无现象,再滴入氯水,溶液变红
溶液中一定有Fe2+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列各组物质相互混合,既有气体放出又有沉淀生成的是( )
①金属钠投入到CuSO4溶液中
②过量的NaOH溶液和明矾溶液
③NaAlO2溶液和NaHCO3溶液混合
④过量的Na2O2投入FeCl2溶液
⑤金属钠投入NH4Cl溶液中
A.①④ B.②③ C.①③ D.①⑤
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤MgCl2(aq)
Mg(OH)2
MgO
A.①②③ B.②③④ C.①③⑤ D.②④⑤
难度: 中等查看答案及解析
-
用以下三种途径来制取相等质量的硝酸铜:
(1)铜跟浓硝酸反应;
(2)铜跟稀硝酸反应;
(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应。
以下叙述中错误的是( )
A.三种途径所消耗的铜的物质的量相等
B.途径三符合绿色化学的理念
C.三种途径所消耗的硝酸的物质的量相等
D.三种途径所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
难度: 中等查看答案及解析
-
含MgCl2、AlCl3均为nmol的混合液,向其中滴加NaOH溶液至过量。有关离子沉淀或沉淀溶解与pH的关系如下表。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是( )
离子
Mg2+
Al3+
物质
Al(OH)3
开始沉淀pH
8.93
3.56
开始溶解pH
8.04
完全沉淀pH
10.92
4.89
完全溶解pH
12.04
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
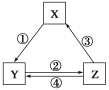
选项
X
Y
Z
A
SiO2
Na2SiO3
H2SiO3
B
NaCl
NaHCO3
Na2CO3
C
N2
NO2
HNO3
D
C
CO
CO2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁粉和铝粉的混合物与足量很稀的硝酸充分反应,无气体放出。在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是( )
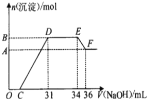
A.溶液中n(NH4+)=0.012mol
B.混合物中铝粉与铁粉物质的量的比为1:2
C.测定F点沉淀的质量,步骤是:过滤、洗涤、低温烘干、称量
D.铝与该浓度硝酸反应的离子方程式为:8Al+30H++3NO3-=8Al3++3NH4++9H2O
难度: 中等查看答案及解析