-
钧瓷是宋代五大名窑瓷器之一,以“入窑一色,出窑万彩”的神奇窑变著称,下列关于陶瓷的说法正确的是( )
A.“窑变”是高温下釉料中的金属化合物发生氧化还原反应导致颜色的变化
B.高品质白瓷晶莹剔透,属于纯净物
C.氮化硅陶瓷属于传统无机非金属材料
D.由于陶瓷耐酸碱,因此可以用来熔化氢氧化钠
难度: 中等查看答案及解析
-
下列有关化合物
的说法正确的是( )
A.所有原子共平面 B.其一氯代物有6种
C.是苯的同系物 D.能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
根据实验目的,设计相关实验,下列实验操作、现象解释及结论都正确的是( )
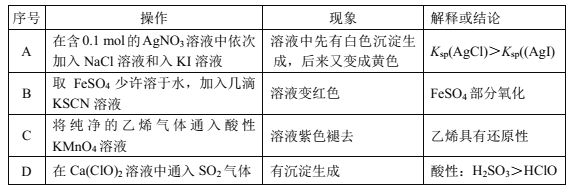
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
A.图1,a点表示的溶液通过升温可以得到b点
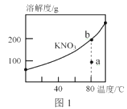
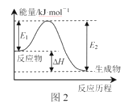
B.图2,若使用催化剂E1、E2、ΔH都会发生改变
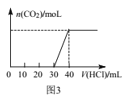
C.图3表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况
D.图4表示反应aA(g)+bB(g)
cC(g),由图可知,a+b>c
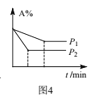
难度: 中等查看答案及解析
-
科学家利用CH4燃料电池(如图)作为电源,用Cu-Si合金作硅源电解制硅可以降低制硅成本,高温利用三层液熔盐进行电解精炼,下列说法不正确的是( )
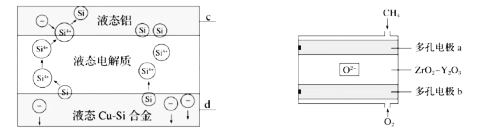
A.电极d与b相连,c与a相连
B.电解槽中,Si优先于Cu被氧化
C.a极的电极反应为CH4-8e-+8OH-=CO2+6H2O
D.相同时间下,通入CH4、O2的体积不同,会影响硅的提纯速率
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期主族元素,X和Y能形成两种常见离子化合物,Z原子最外层电子数与其电子层数相同;X与W同主族。下列叙述不正确的是( )
A.原子半径:Y>Z>W>X
B.X、Y形成的Y2X2阴阳离子数目比为1:1
C.Y、Z和W的最高价氧化物的水化物可以相互反应
D.X与W形成的化合物可使紫色石蕊溶液变红
难度: 中等查看答案及解析
-
向某二元弱酸H2A水溶液中逐滴加入NaOH溶液,混合溶液中lgx(x为
或
)与pH的变化关系如图所示,下列说法正确的是( )

A.pH=7时,存在c(Na+)=c(H2A)+c(HA-)+c(A2-)
B.直线Ⅰ表示的是lg
随pH的变化情况
C.
=10-2.97
D.A2-的水解常数Kh1大于H2A电离常数的Ka2
难度: 困难查看答案及解析
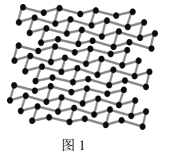
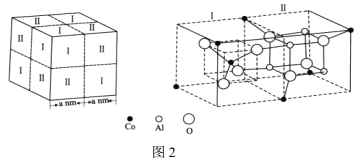
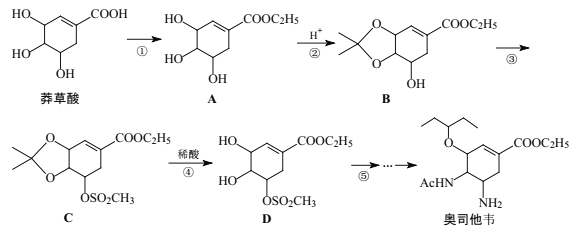
 +H2O
+H2O