-
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热难度: 中等查看答案及解析
-
已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量
②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量
下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol难度: 中等查看答案及解析
-
下列说法正确的是( )
A.稀有气体形成的晶体属于分子晶体
B.原子晶体中只存在非极性共价键
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物难度: 中等查看答案及解析
-
下列物质中,其水溶液能导电、溶于水时化学键被破坏,且该物质属于非电解质的是( )
A.I2
B.BaCO3
C.CO2
D.C6H12O6(葡萄糖)难度: 中等查看答案及解析
-
关于氢键,下列说法正确的是( )
A.H2O是一种非常稳定的化合物,这是由于氢键所致
B.分子间形成的氢键使物质的熔点和沸点升高
C.氨在水中溶解度很大,与氨与水分子之间形成分子间氢键无关
D.氢键比范德华力强,所以它属于化学键难度: 中等查看答案及解析
-
下列有关胶体的说法中正确的是( )
A.胶体都是均匀透明的液体
B.丁达尔现象可以鉴别胶体和溶液
C.电泳现象能证明胶体微粒比溶液中溶质微粒直径大
D.纳米材料的微粒直径一般在几纳米到几十纳米,因此纳米材料是胶体难度: 中等查看答案及解析
-
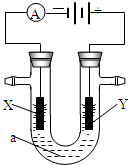
下列各烧杯中均盛着海水,铁在其中被腐蚀由快到慢的顺序为( )
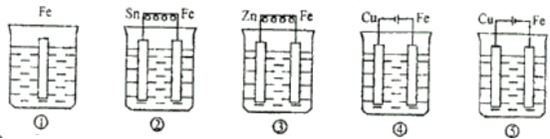
A.①②③④⑤
B.②①③④⑤
C.④②①③⑤
D.④⑤①②③难度: 中等查看答案及解析
-
用惰性电极电解M(NO3)x的水溶液,当阴汲上增重ag时,在阳极上同时产生bL氧气(标准状况〕:从而可知M的原子量为( )
A.22.4ax/b
B.11.2ax/b
C.5.6ax/b
D.2.5ax/b难度: 中等查看答案及解析
-
用两支惰性电极插入500毫升AgNO3溶液中,通电电解.当电解液的pH值从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上应析出银的质量是( )
A.27毫克
B.54毫克
C.108毫克
D.216毫克难度: 中等查看答案及解析
-
下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiO2CsClCBr4CF4
B.SiO2CsClCF4CBr4
C.CsClSiO2CBr4CF4
D.CF4CBr4CsClSiO2难度: 中等查看答案及解析
-
下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快难度: 中等查看答案及解析
-
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1,则下列表述正确的是( )
A.在两个阴极上得到的银和汞的物质的量之比n(银):n(汞)=2:1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的分子式为HgNO3
D.硝酸亚汞的分子式为Hg2(NO3)2难度: 中等查看答案及解析
-
镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池.镍氢电池的总反应式是:
H2+NiO(OH)
Ni(OH)2.根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,氢气在正极反应难度: 中等查看答案及解析
-
有A、B、C、D四种金属.将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀.将A、D分别投入等浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化.如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
A.D>C>A>B
B.D>A>B>C
C.D>B>A>C
D.B>A>D>C难度: 中等查看答案及解析
-
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )
A.CuCl2(CuSO4)
B.NaOH(NaOH)
C.KCl(HCl)
D.CuSO4(Cu(OH)2)难度: 中等查看答案及解析
-
如图中三个电解装置中都盛有相同体积、相同物质的量浓度的CuSO4溶液,通电一段时间并且通过的电量相同时,CuSO4溶液物质的量浓度大小关系正确的是( )
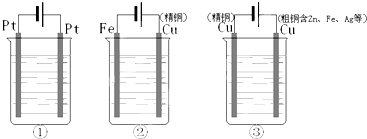
A.②>③>①
B.①>②>③
C.②=③>①
D.①=②=③难度: 中等查看答案及解析
-
燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液,下列关于甲烷燃料电池的说法正确的是( )
A.负极反应式:O2+2H2O+4e-═4OH-
B.负极反应式:CH4+10OH--8e-═CO32-+7H2O
C.随着放电的进行,溶液的pH不变
D.放电时溶液中的阴离子向正极移动难度: 中等查看答案及解析
-
已知Cl-、Fe2+、H2O2、I-、SO2均具有还原性,且在酸性溶液中的还原性依次增强.下列各反应不可能发生的是( )
A.2Fe2++Cl2═2Fe3++2Cl-
B.2Fe3+十SO2十2H2O=2Fe2+十SO42-十4H+
C.H2O2十H2SO4=SO2↑十O2↑十2H2O
D.SO2十I2十2H2O=H2SO4十2HI难度: 中等查看答案及解析
-
G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的分子式或化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
(1)G→Q十NaCl
(2)Y十NaOH→G十Q十H2O
(3)Q+H2OX+H2
(4)Z十NaOH→Q十X十H2O
这五种化合物中氯的化合价由低到高的顺序为( )
A.QGZYX
B.GYQZX
C.GYZQX
D.ZXGYQ难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O;△H=-57.3kJ/mol.分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,它们的关系表示正确的是( )
A.△H2<△H3<△H1
B.△H1>△H2>△H3
C.△H1=△H2=△H3
D.△H2>△H3>△H1难度: 中等查看答案及解析
-
在吸收塔用98.3%的浓硫酸而不是用水吸收SO3的原因是( )
A.用浓硫酸吸收不形成酸雾,吸收速率快
B.用水吸收生成的酸雾多,影响吸收
C.用水不能吸收SO3
D.用浓硫酸吸收可以得到更浓的硫酸难度: 中等查看答案及解析
-
在硫酸的工业制法中,下列生产操作与说明的原因二者都正确的是( )
A.硫铁矿燃烧前需将矿粒粉碎,这样易于向沸腾炉中投料
B.炉气进入接触室之前需要净化、干燥,因为炉气中的杂质易与SO2反应
C.SO2氧化为SO3时需使用催化剂,这样可提高SO2的转化率
D.接触室的反应温度控制在400~500℃,因为在该温度范围内催化剂的活性较高难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(g)+O2(g )═CO2(g),△H1; C(g)+O2(g)═CO(g ),△H2;
②S(s)+O2(g )═SO2(g),△H3; S(g)+O2(g)═SO2(g),△H4;
③H2(g)+O2(g )═H2O(l),△H5; 2H2(g)+O2(g)═2H2O(l),△H6;
④CaCO3(s)═CaO(s)+CO2(g),△H7; CaO(s)+H2O (l)═Ca(OH)2(s),△H8.
A.①②③
B.②③④
C.④
D.①难度: 中等查看答案及解析
-
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l);△H=-4b kJ/mol
B.C2H2(g)+O2(g)→2CO2(g)+H2O(l);△H=2b kJ/mol
C.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l);△H=-2b kJ/mol
D.2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l);△H=b kJ/mol难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9kJ•mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1
难度: 中等查看答案及解析