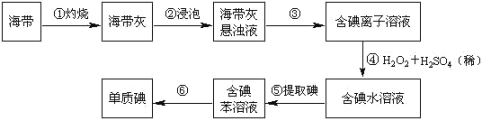
-
下列说法正确的是
A. 非金属单质中一定存在共价键
B. 任何物质中都存在化学键
C. 含离子键的化合物一定是离子化合物
D. 溶于水能导电的化合物就是离子化合物
难度: 简单查看答案及解析
-
下列说法正确的是
A.元素周期表中元素排序的依据是元素的相对原子质量
B.元素周期表中元素排序的依据是原子的核电荷数
C.元素周期表有十六个纵行,也就是十六个族
D.元素周期表已发展成为一个稳定的形式,它不可能再有任何新的变化了
难度: 简单查看答案及解析
-
关于原子结构模型的说法不正确的是( )
A.道尔顿提出了物质是由原子组成,原子在化学变化中是不可分的学说
B.汤姆生提出了原子的“葡萄干面包式”的结构模型
C.卢瑟福根据粒子散射现象提出了带核的原子结构模型
D.玻尔提出了量子力学模型
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.34S 原子核内的中子数为 16
B.1H 和 2H 的化学性质相同
C.H216O 与H218O 互为同素异形体
D.Na2O2和H2O2含有的化学键类型相同
难度: 简单查看答案及解析
-
下列各组物质含有的化学键类型完全相同的是
A.HBr、CO2、NH3 B.Na2O、Na2O2、Na2S
C.NaCl、HCl、H2O D.NaOH、CaCl2
难度: 中等查看答案及解析
-
下列说法中正确的是( )
①质子数相同的微粒一定属于同一种元素
②电子数相同的微粒不一定是同一种元素
③两个原子如果核外电子排布相同,一定是同一种元素
④质子数相同,电子数也相同的两种微粒,不可能是一种分子和一种离子
⑤所含质子数和电子数相等的微粒一定是原子
⑥同种元素的原子其质量数必相等
A.①②④ B.②③④ C.③④⑥ D.①⑤⑥
难度: 简单查看答案及解析
-
部分短周期元素化合价与原子序数的关系如图,下列说法正确的是( )

A.原子半径:Z > Y > X
B.气态氢化物的稳定性 R < W
C.Y 和 Z 的最高价氧化物对应的水化物能相互反应
D.W 与 X 形成的化合物只有一种
难度: 简单查看答案及解析
-
有些科学家提出硅是“21世纪的能源”,下列有关硅及其化合物的说法正确的是
A.硅在自然界中以游离态和化合态两种形式存在
B.硅晶体是良好的半导体,可用于制造光导纤维
C.SiO2是酸性氧化物,不与任何酸发生反应
D.木材浸过水玻璃后,不易着火
难度: 简单查看答案及解析
-
已知33As是第VA族元素,与35Br位于同一周期,下列关系正确的是( )
A. 还原性:
B. 热稳定性:
C. 原子半径:
D. 酸性:
难度: 困难查看答案及解析
-
2016 年 IUPAC 命名 117 号元素为 Ts,已知 Ts 位于第七周期,其原子核外最外层电子数为 7。下列说法正确的是( )
A.Ts的同位素原子具有不同的核外电子数
B.Ts 元素具有放射性
C.Ts 在同族元素中非金属性最强
D.中子数为 176 的 Ts 核素符号为
难度: 简单查看答案及解析
-
X、Y、Z 均为元素周期表中前20号元素,Xb+、Yb−、Z(b+1)−三种简单离子的电子层结构相同,下列说法正确的是( )
A.原子半径:Z > Y > X
B.离子半径:Yb− > Z(b+1)− > Xb+
C.Z(b+1)−的还原性一定大于Yb−
D.气态氢化物的稳定性:Hb+1Z > HbY
难度: 中等查看答案及解析
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.短周期元素形成离子后,最外层电子达到都达到8电子稳定结构
B.所有主族元素的正化合价数等于它的族序数
C.第3、4、5、6周期元素的数目分别是8、18、32、32
D.第4周期由左至右第8、9、10三列中没有非金属元素
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价见下表:( )
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+ 2
+ 3
+ 6、− 2
+ 2
− 2
下列叙述正确的是( )
A.Q 的氢化物不能与其最高价氧化物对应的水化物反应
B.T 的气态氢化物分子间存在共价键
C.M 与 T 形成的化合物能与 NaOH 溶液反应
D.L、Q 形成的简单离子核外电子数相等
难度: 简单查看答案及解析
-
图为周期表的一小部分,A、B、C、D、E 的位置关系如图所示。其中 B 元素最高化合价是最低化合价绝对值的 3 倍,它的最高价氧化物中含氧 60%。下列说法正确的( )
A.D、B、E 三种元素的非金属性逐渐减小
B.B 元素最高价氧化物对应的水化物是强酸
C.A 元素是空气中含量最多的元素
D.气态氢化物的稳定性顺序: D > B > E
难度: 简单查看答案及解析
-
已知 X、Y 是两种短周期主族元素,下列有关说法中一定正确的是( )
选项
条件
结论
A
原子半径:X > Y
原子序数:X < Y
B
最高价氧化物对应的水化物的酸性:X > Y
元素的非金属性:X > Y
C
最外层电子数:X > Y
最高正价:X > Y
D
X、Y 最外层电子数分别为 1、7
X、Y 之间一定能形成离子键
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列关于氧化铝和氢氧化铝的叙述错误的是( )
A. Al(OH)3受热能分解
B. Al2O3既能溶于强酸溶液又能溶于强碱溶液
C. Al(OH)3胶体能吸附水中的悬浮物
D. Al(OH)3与过量的浓氨水反应生成NH4[Al(OH)4]
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知:四种原了最外层电子数之和为24。下列说法止确的是
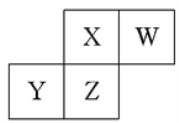
A.元素Ⅹ和元Z的最高正化合价相同
B.单核阴离子半径的大小顺序为:r(W)>r(X)
C.气态简单氢化物的热稳定性顺序为:Y<Z<X<W
D.元素Z的氧化物对应水化物都是强酸
难度: 中等查看答案及解析
-
中国科学院科研团队研究发现,在常温常压和可见光下,基于 LDH(一种固体催化剂)合成NH3的原理示意图如图所示。下列说法不正确的是( )
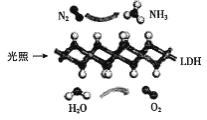
A.该反应属于置换反应
B.该过程中只涉及极性键的断裂与生成
C.基于 LDH 合成 NH3的过程属于氮的固定
D.该过程中每生成 2.24L(标准状况)O2则转移 0.4mol 电子
难度: 中等查看答案及解析