-
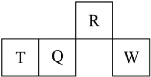
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
难度: 中等查看答案及解析
-
下列各组化合物中,化学键类型完全相同的是:( )
A.HCl 和NaOH B.Na2O 和Na2O2
C.CO2和 CaO D.CaCl2和 Na2S
难度: 简单查看答案及解析
-
有德国重离子研究中心人工合成的第 112 号元素的正式名称为“Copernicium”,相应的 元素符号位“Cn”。该元素的名称是为了纪念天文学家哥白尼而得名。该中心人工合成 Cn 的过程可表示为:
Zn+
Pb=
Cn+
n,下列叙述中正确的是
A.
Cn 的原子核内中子数比质子数多 53
B.Cn 元素的相对原子质量为 277
C.上述合成过程中属于化学变化
D.Cn 元素位于元素周期表的第六周期,是副族元素
难度: 简单查看答案及解析
-
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是( )
A.a=b+m+n B.a=b-m+n C.a=b+m-n D.a=b-m-n
难度: 中等查看答案及解析
-
汽车尾气在光照下分解时,即开始光化学烟雾的循环,它的形成过程可用下列化学方程式表示:NO2===NO+O,2NO+O2===2NO2,O2+O===O3。下列有关叙述不正确的是( )
A.此过程中,NO2是催化剂
B.在此过程中,NO是中间产物
C.此过程的总反应方程式为2O3===3O2
D.光化学烟雾能引起人的外呼吸功能严重障碍
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述中正确的是( )
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态
C.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
D.平衡混合物中各物质的量浓度相等
难度: 简单查看答案及解析
-
下列各项操作,错误的有
A.进行分液时,分液漏斗中的下层液体,从下端流出,上层液体则从上口倒出
B.萃取、分液前需对分液漏斗检漏
C.蒸馏时,必须将温度计的水银球放在蒸馏烧瓶支管口附近
D.用乙醇萃取溴水中的溴单质的操作可选用分液漏斗
难度: 简单查看答案及解析
-
某元素形成气态氢化物的分子式为HnR,其最高价氧化物对应水化物分子式中有m个氧原子,则其最高价氧化物对应水化物化学式为( )
A.H2m-8+nROm B.H2n-8+mROm C.H2ROm D.H2mROm
难度: 中等查看答案及解析
-
在反应C(s)+CO2(g)=2CO(g)中,能使反应速率加快的是
①增大压强 ②升高温度 ③将C粉碎 ④通CO2气体 ⑤加入足量木炭粉
A.①②③ B.①②④ C.①②③④ D.全部
难度: 简单查看答案及解析
-
若R元素原子的质量数为A,Rm-的核外电子数为x,则w g Rm-所含中子的物质的量为( )
A.(A-x+m) mol B.(A-x-m) mol
C.
(A-x+m) mol D.
(A-x-m) mol
难度: 中等查看答案及解析
-
可逆反应:
在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成
的同时生成
②单位时间内生成
的同时生成
③用
、
、
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
微量硒元素(Se)对人体有保健作用,我国鄂西地区含有丰富的硒矿资源。已知硒与氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是
A.硒的氧化物以 Se2O3 形式存在 B.硒的氢化物以 H2Se 形式存在
C.硒的氢化物的稳定性比硫化氢差 D.硒的最高价氧化物的水化物的化学式是 H2SeO4
难度: 中等查看答案及解析
-
Na3N是离子化合物,它和水作用可产生NH3。下列叙述正确的是( )
A. Na+和N3-的电子层结构都与氖原子相同
B. Na+的半径大于N3-的半径
C. Na3N与足量的盐酸反应后生成一种盐
D. 在Na3N与水的反应中,Na3N作还原剂
难度: 中等查看答案及解析
-
从海带中提取碘单质的工艺流程如下。下列关于海水制碘的说法,不正确的是( )
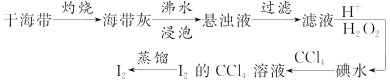
A. 在碘水中加入几滴淀粉溶液,溶液变蓝色
B. 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
C. 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
D. 碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
难度: 中等查看答案及解析
-
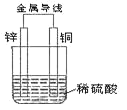
锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
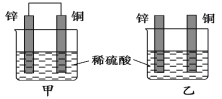
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.产生气泡的速度甲比乙慢
D.两烧杯中溶液的 H+的浓度均减小
难度: 简单查看答案及解析
-
已知可逆反应
,在不同情况下测其反应速率,其中反应速率
最快的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
科学家已获得了气态N4分子,其结构为正四面体(如图所示)。已知断裂1 mol N—N吸收167 kJ能量,断裂1 mol N≡N吸收942 kJ能量,下列说法正确的是

A.N4属于一种新型的化合物
B.N4(g)=4N(g)的过程中释放1002 kJ能量
C.1 mol N4转化为N2时要吸收882 kJ能量
D.N4和N2互为同素异形体,N4转化为N2属于化学变化
难度: 中等查看答案及解析
-
在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2mol•L-1 降到 0.8mol•L-1 需要 20s,那么反应物浓度再由 0.8mol•L-1 降到 0.2mol•L-1 所需要的时间为
A.10s B.大于 10s C.小于 10s D.无法判断
难度: 中等查看答案及解析
-
科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下。
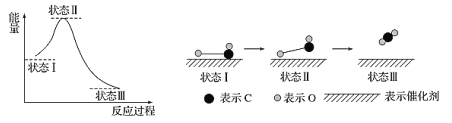
下列说法不正确的是
A. CO2含有极性共价键 B. 上述过程表示CO和O生成CO2
C. 上述过程中CO断键形成C和O D. 从状态Ⅰ到状态Ⅲ,有能量放出
难度: 中等查看答案及解析
-
甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是
( )。
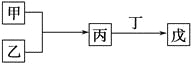
A.若组成甲、乙的元素位于同一周期,则戊可能是一种弱酸
B.若组成甲、乙的元素位于同一主族,则戊可能是一种弱酸
C.若甲为短周期中原子半径最大的主族元素形成的单质,且戊为碱,则丙只能为Na2O2
D.若丙、丁混合生成白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
难度: 中等查看答案及解析
-
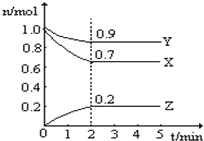
已知合成氨反应的浓度数据如表:当用氨气 浓度的增加来表示该化学反应速率时,其速率为
N2 + 3H2
2 NH3
起始浓度 mol/L
1.0
3.0
0
2 秒末浓度 mol/L
0.6
1.8
0.8
A.0.2 mol/(L·s) B.0.4 mol/(L·s)
C.0.6 mol/(L·s) D.0.8 mol/(L·s)
难度: 简单查看答案及解析
-
mA(g)+nB(g)
pC(g)的速率和平衡的影响图像如下,下列判断正确的是
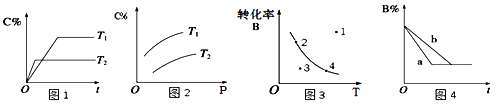
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
难度: 简单查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
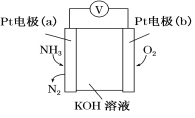
A.O2在电极b上发生还原反应
B.溶液中OH-向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4∶5
D.负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
难度: 中等查看答案及解析