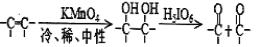-
化学与生活密切相关,下列说法不正确的是( )
A.医用“纳米银外用抗菌凝胶”外用于皮肤后,能够缓释放出纳米银离子,抑制并杀灭与之接触的病菌并有促进皮肤愈合的作用
B.银是首饰行业中常用的金属材料,纯银由于太软,因此,常掺杂其他组分(铜、锌、镍等),标准首饰用银的银含量为92.5%,又称925银
C.分别用液化石油气、汽油、地沟油加工制成的生物柴油都是碳氢化合物
D.液氯罐泄漏时,可将其移入水塘中,并向水塘中加入熟石灰
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.30g丙醇中存在的共价键总数为5NA
B.1molD2O与1molH2O中,中子数之比为2:1
C.含0.2molH2SO4的浓硫酸与足量的镁反应,转移电子数大于0.2NA
D.密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加2NA个P-Cl键
难度: 中等查看答案及解析
-
已知A、B、C、D为由短周期元素组成的四种物质,它们有如图所示转化关系,且D为强电解质(其他相关物质可能省略)。
下列说法不正确的是( )
A.若A是共价化合物,则A和D有可能发生氧化还原反应
B.若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第ⅣA族
C.若A为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2:3
D.若A是金属或非金属单质,则常温下0.1mol/L的D溶液中由水电离出的c(H+)可能为10-13mol/L
难度: 中等查看答案及解析
-
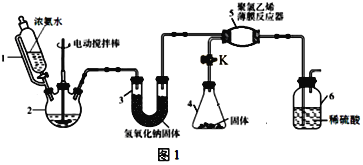
某热再生电池工作原理如图所示。放电后,可利用废热进行充电。已知电池总反应:Cu2++4NH3
[Cu(NH3)4]2+ ΔH<0。下列说法正确的是( )

A.充电时,能量转化形式主要为电能到化学能
B.放电时,负极反应为NH3-8e-+9OH-=NO3-+6H2O
C.a为阳离子交换膜
D.放电时,左池Cu电极减少6.4g时,右池溶液质量减少18.8g
难度: 中等查看答案及解析
-
四氢噻吩(
)是家用天然气中人工添加的气味添加剂具有相当程度的臭味。下列关于该化合物的说法正确的是( )
A.不能在O2中燃烧
B.
所有原子可能共平面
C.
与Br2的加成产物只有一种
D.生成1molC4H9SH至少需要2molH2
难度: 中等查看答案及解析
-
某化学小组设计了如图甲所示的数字化实验装置,研究常温下,向1L0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的粒子的物质的量分数与溶液pH的关系如图乙所示,则下列说法中正确的是( )
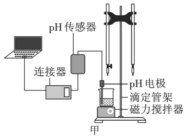
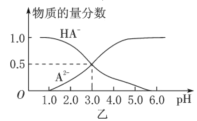
A.pH=4.0时,图中n(HA-)约为0.0091mol
B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C.该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂
D.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
难度: 中等查看答案及解析

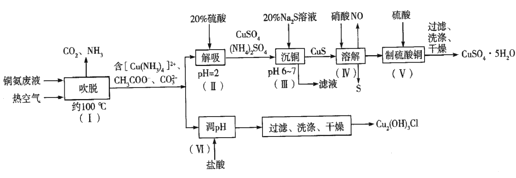


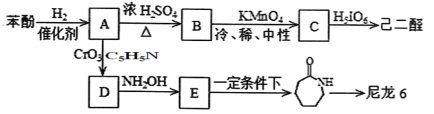
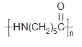 )的合成路线如图:
)的合成路线如图: