-
有资料报道,前几年我国部分地区陆续发现了“毒油”。所谓的“毒油”是指混有汽油的食用油,不能食用。下列有关说法正确的是( )
A.汽油可以由石油的分馏得到 B.汽油是纯净物,有固定的熔沸点
C.可用静置后看其是否分层来判断食用油中是否混有汽油 D.裂化汽油可以作为溴水中提取溴的萃取剂
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.天然气和液化石油气都属于化石燃料,它们的主要成分都是甲烷
B.蛋白质、纤维素、蔗糖、油脂都是高分子化合物
C.纤维素、葡萄糖和脂肪在一定条件下都可发生水解反应
D.用大米酿的酒在一定条件下密封保存,时间越长越香醇
难度: 简单查看答案及解析
-
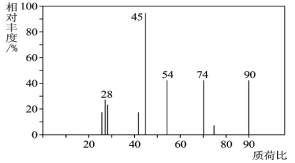
最近日本科学家确认世界还存在着另一种“分子足球”
,它与
分子结构相似,
在高温和撞击后会释放出巨大能量,下列对
的说法不正确的是( )
A.
高温和撞击后应该生成
B.
和
都是氮的同素异形体
C.
中氮原子之间由共价键结合 D.
和
都是氮的同位素
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.质量数为31的磷原子:
B.
和
原子结构示意图均可以表示为:
C.
的电子式:
D.
的结构式:
难度: 简单查看答案及解析
-
下列各组物质分类正确的是( )
非电解质
电解质
酸
碱
盐
氧化物
A.
氯气
氢氧化钠
二氧化碳
苏打
食盐
水
B.
酒精
氨水
碳酸
小苏打
明矾
水晶
C.
二氧化碳
氯化钠
硫酸
火碱
小苏打
生石灰
D.
酒精
铝
盐酸
熟石灰
石灰石
氧化铁
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
能正确表示下列反应的方程式的是( )
A.
与水反应:
B.
溶液中加入
溶液:
C.铁粉和水蒸气反应:
D.含有
的溶液中,通入
难度: 中等查看答案及解析
-
某溶液中含大量
离子,其中加入足量的
固体后,再加入足量盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
设
表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,
二氧化硫含有的原子数等于
B.标准状况下,
中所含分子数为
C.常温常压下,
水所含电子数为
D.常温常压下,
与
混合物含有的硫原子数为
难度: 中等查看答案及解析
-
下列实验合理的是
A.
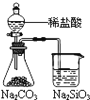 证明非金属性
证明非金属性B.
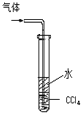 吸收氨气,并防止倒吸
吸收氨气,并防止倒吸C.
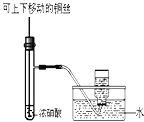 制备并收集少量
制备并收集少量气体
D.
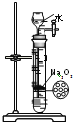 制备少量氧气
制备少量氧气难度: 中等查看答案及解析
-
由下列实验及现象不能推出相应结论的是
实验
现象
结论
A.
向
的溶液中加足量铁粉,振荡,滴入几滴
溶液
黄色逐渐消失,加
溶液颜色不变
还原性:
B.
将金属钠在燃烧匙中点燃,迅速伸入集满
的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
具有氧化性
C.
将足量的
通入
溶液中,向反应后的溶液加入酸性
溶液
酸性
溶液紫红色褪去
与
发生了氧化还原反应
D.
将
的
溶液滴入
溶液至不再有沉淀产生,再滴加
的
溶液
先有白色沉淀生成,后变为蓝色沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
体积相同、
相同的
溶液、
溶液和
溶液,与
溶液中和时三者消耗
的物质的量( )
A.相同 B.中和
的多 C.中和
的多 D.中和
的多
难度: 中等查看答案及解析
-
和
充入体积不变的密闭容器中,在一定条件下发生下列反应:
,到达平衡时,
为
,如果此时移走
和
,在相同温度下再达平衡时
的物质的量是( )
A.
B.
C.大于
,小于
D.小于
难度: 中等查看答案及解析
-
下列说法正确的是
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) △H = +185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.化学反应的限度不可以通过改变条件而改变
难度: 中等查看答案及解析
-
将反应
设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
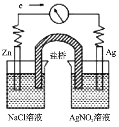
A.
盐桥中的
移向
溶液
B.
作负极,发生还原反应
C.若将盐桥换成银丝,工作一段时间后,
溶液中
减小
D.若将盐桥换成银丝,当锌电极质量减少
,银电极质量增加
难度: 中等查看答案及解析
-
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
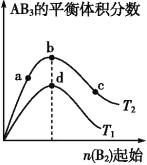
A. 图中T2一定大于T1
B. 图中b点速率一定大于d点速率
C. 达到平衡时,A2的转化率大小为c>b>a
D. 加入催化剂可以使状态d变为状态b
难度: 困难查看答案及解析
-
在常温下,向
溶液中逐滴加入
溶液,混合溶液的
变化情况如图中所示曲线(体积变化忽略不计)。下列叙述正确的是( )
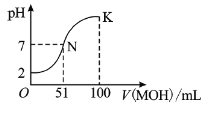
A.
溶液的
B.
点时加水稀释溶液,
减小
C.在
点,
D.在
点,
难度: 中等查看答案及解析
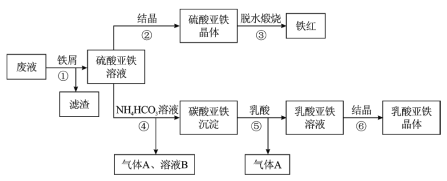

 B
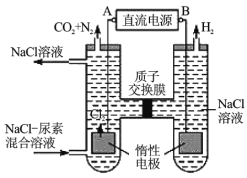
B 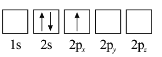
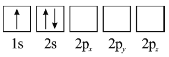
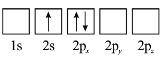 D
D 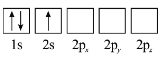
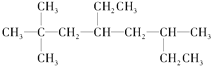 ,用系统命名法命名烃A:____________。
,用系统命名法命名烃A:____________。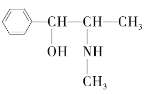 ,下列各物质:A.
,下列各物质:A. 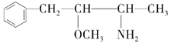 C.
C. 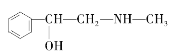 D.
D. 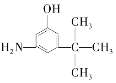 E.
E.