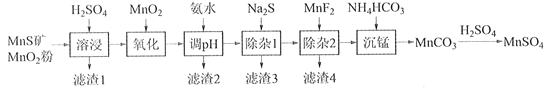
-
下列说法正确的是( )
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
C.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32-
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
难度: 中等查看答案及解析
-
下列有关金属及其化合物的不合理的是( )
A. 将废铁屑加入
溶液中,可用于除去工业废气中的
B. 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多
等)不利于作物生长,可施加熟石灰进行改良
D. 无水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
难度: 中等查看答案及解析
-
下列说法正确的是
A.
与
都是α-氨基酸且互为同系物
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物按系统命名法,化合物
的名称是2,3,4-三甲基-2-乙基戊烷
D.
的一溴代物和
的一溴代物都有4种(不考虑立体异构)
难度: 中等查看答案及解析
-
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是

A.分子中N、O间形成的共价键是非极性键
B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性
D.15.2g该物资含有6.02×
个原子
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W <X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
难度: 中等查看答案及解析
-
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得。下列叙述正确的是( )
 +H2O
+H2OA.贝诺酯分子中有三种含氧官能团
B.贝诺酯与足量 NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
C.乙酰水杨酸和对乙酰氨基酚均能与 NaHCO3溶液反应
D.可用 FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚
难度: 中等查看答案及解析
-
为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是
选项
实验目的
主要仪器
试剂
A
分离Br2和CCl4混合物
分液漏斗、烧杯
Br2和CCl4混合物、蒸馏水
B
鉴别葡萄糖和蔗糖
试管、烧杯、酒精灯
葡萄糖溶液、蔗糖溶液、银氨溶液
C
实验室制取H2
试管、带导管的橡皮塞
锌粒、稀HNO3
D
测定NaOH溶液浓度
滴定管、锥形瓶、烧杯
NaOH溶液,0.1000mol/L盐酸
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
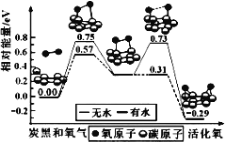
我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如图:
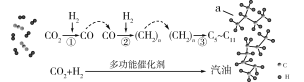
下列说法不正确的是( )
A.反应①的产物中含有水
B.反应②中只有碳碳键形成
C.汽油主要是C5~C11的烃类混合物
D.图中a的名称是2-甲基丁烷
难度: 中等查看答案及解析
-
连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH 和水形成的混合液,通入 SO2 时发生反应生成保险粉和一种常见气体,下列说法错误的是( )
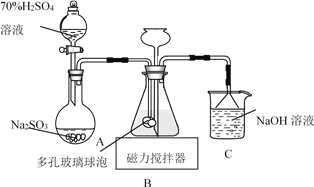
A.制备保险粉的离子方程式为:HCOO-+OH-+2SO2=S2O42-+CO2↑+H2O
B.多孔玻璃球泡的作用是增大气体与溶液的接触面积,使 SO2 能被充分吸收
C.NaOH 溶液的主要作用是吸收逸出的CO2
D.为避免 Na2S2O4 被 O2 氧化,使硫酸与亚硫酸钠先反应,产生的 SO2 排出装置中的 O2
难度: 中等查看答案及解析
-
用废铁屑制备磁性胶体粒子,制取过程如下:

下列说法不正确的是
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B.通入N2是防止空气中的O2氧化二价铁元素
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+=2Fe3++2 H2O
D.溶液A中Fe2+和Fe3+的浓度比为2:1
难度: 中等查看答案及解析
-
MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g)
M2+(g)+O2−(g)+CO2(g)

已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
难度: 困难查看答案及解析
-
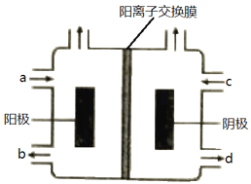
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)
ZnO(s)+2Ni(OH)2(s)。以下说法不正确的是
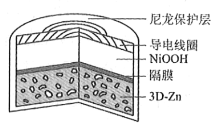
A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH−(aq)−e−
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH−(aq)−2e−
ZnO(s)+H2O(l)
D. 放电过程中OH−通过隔膜从负极区移向正极区
难度: 困难查看答案及解析
-
科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是
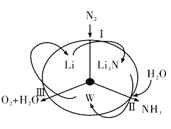
A. 过程I得到的Li3N的电子式为
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
难度: 中等查看答案及解析
-
室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、
c(CH3COO-)与pH的关系如图所示。下列有关叙述正确的是
 [
[A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)+c(OH-)
B.向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l
D.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)-
难度: 中等查看答案及解析

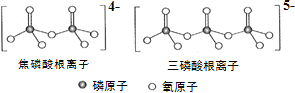
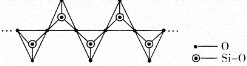
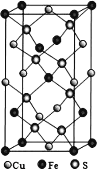
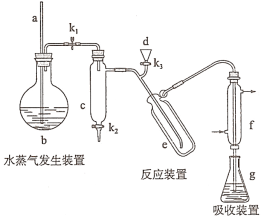
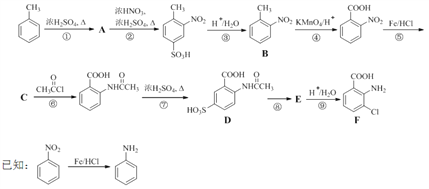
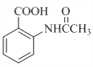 为主要原料,经最少步骤制备含肽键聚合物的流程。__________
为主要原料,经最少步骤制备含肽键聚合物的流程。__________