-
(1)下列元素或化合物的性质变化顺序正确的是__________________
A.第一电离能:Cl>S>P>Si
B.共价键的极性:HF>HCl>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI
D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
(2)FeCl3 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 FeCl3 的结构式为_________,其中 Fe 的配位数为___________________
(3)NH4H2PO4 中,电负性最高的元素是________;P的________________杂化轨道与 O的2p轨道形成______键。NH4H2PO4 和 LiFePO4 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐, 如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示。这类磷酸根离子的化学式可用通式表示为 ______________(用 n 代表 P 原子数)。
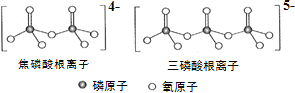
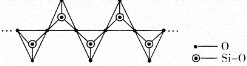
(4)高温高压下 CO2 的晶体结构与SiO2 相似,该晶体熔点比 SiO2 晶体____________(填“高”或“低”)。硅酸盐和 SiO2 一样,都是以硅氧四面体作为基本结构单元,图中表示一种含 n 个硅原子的单链式多硅酸根的结构(投影如图),Si 原子的杂化类型为_______________,其化学通式可表示为____________________
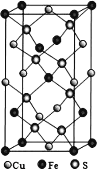
(5)四方晶系 CuFeS2 晶胞结构如图所示(下一页)。Cu2+的配位数为_______________,S2-的配位数为__已知:a=b=0.524 nm,c=1.032 nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是_________________ g•cm-3(列出计算式)。
-
【化学—选修3:物质结构与性质】(15分)中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物。回答下列问题:
(1)氮、磷、钾三种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)叠氮酸(HN3)是一种弱酸,可电离出H+和N3一。
①N3一的立体构型是 形:与N3一互为等电子体的一种分子是 (填分子式)。
②叠氮化物能与Co 3十形成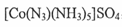 ,该配合物中心离子的配位数为 ;
,该配合物中心离子的配位数为 ;
基态钻原子的价层电子排布式为
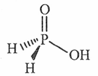
(3)磷能形成多种含氧酸,某资料认为次磷酸的结构如图。按此结构,P原子采用的杂化方式为 ,次磷酸分子中 键与
键与 键数目之比为 ,次磷酸属于 酸(填“强”或“弱,’),lmol次磷酸最多能与 mo1NaOH发生中和反应。
键数目之比为 ,次磷酸属于 酸(填“强”或“弱,’),lmol次磷酸最多能与 mo1NaOH发生中和反应。
(4)己知钾的一种化合物KIC12受热可分解,倾向于生成晶格能更大的物质。则下列化学反应更易发生的是

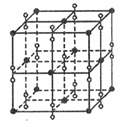
(5)钾在氧气中燃烧时得到多种氧化物,其中一种是面心立方结构,晶胞结构如下图所示。若该氧化物的密度是 ,则晶胞中最近的两个钾离子间的距离为 pm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值)。
,则晶胞中最近的两个钾离子间的距离为 pm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值)。
-
【化学——物质结构与性质】13分)
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
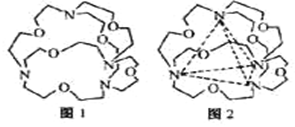
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
-
【化学—物质结构与性质】
碳是形成化合物种类最多的元素。
(1)C、N、O三种元素的第一电离能由大到小的顺序为______,碳的最简单气态氢化物中心原子的杂化类型为___________。
(2)类肉素[(SCN)2]的结构式为N C—S—S—C
C—S—S—C N。其分子中
N。其分子中 键和
键和 键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C
键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
(3)位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同的元素,其基态原子的价层电子排布式为 ____________。
(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能,其晶胞结构如图所示(其中·为碳原子,○为硅原子)。每个碳原子周围与其距离最近的硅原子有_____个;设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为__________(用含a、b的式子表示).

-
[化学—选修3:物质结构与性质](15分)Fe2+、Fe3+与O22—、CN—、F—、有机分子等形成的化合物具有广泛的应用。
(1)N、O、F三种元素原子的第一电离能由大到小的顺序是 。
(2)基态Fe3+核外M能层的电子排布式为 。
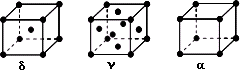
(3)铁有δ、γ、α三种同素异形体(如下图),则γ晶胞原子堆积名称为_____________。假设各种晶型的铁单质都是由半径为r的铁原子堆积而成,则晶胞δ与晶胞α的密度比为_______________(列式并化简)。
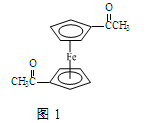
(4)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示。此物质中碳原子的杂化方式有 。
(5)配合物K3[Fe(CN)6]可用于电子传感器的制作。与配体互为等电子体的一种分子的电子式为 。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为 。
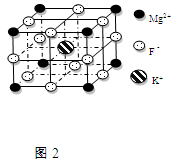
(6)F—不仅可与Fe3+形成[FeF6]3—,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示。该晶体的化学式为 。在该晶体中与一个F—距离最近且相等的F—的个数为 。
-
【选修3——物质结构与性质】ⅢA、VA的某些单质及其化合物常用于制作太阳能电池、半导体材料等。
(1)基态时As原子核外的电子排布式为 。
(2)硒、溴与砷同周期,三种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)气态SeO3分子的立体结构为 ,与SeO3互为等电子体的一种离子为 (填化学式)。
(4)硼元素具有缺电子性,因而其化合物往往具有加和性。
①硼酸(H3BO3)是一元弱酸,写出硼酸在水溶液中的电离方程式 。
②硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有 mol氢键, molσ键。H3BO3中B的原子杂化物类型为 。

(5)硅的某种单质的晶胞如右图所示。GaN晶体与该硅晶体相似。则GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为 。若该硅晶体的密度为ρg·cm-3,阿伏伽德罗常数值为NA,则晶体中最近的两个硅原子之间的距离为 cm(用代数式表示即可)
-
氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途。
(1)基态砷原子的核外电子排布式为________。氮、磷、砷的第一电离能顺序为__________>__________>__________(填元素符号)。
(2)已知N2O为直线形结构,结构式为N=N=O。则N2O是__________(填“极性”或“非极性”)分子。中间的氮原子的杂化轨道类型为__________杂化。
(3)已知下列数据:
| 物质 | 熔点/K | 沸点/K | 分解温度/K |
| NH3 | 195.3 | 239.7 | 1073 |
| PH3 | 139.2 | 185.4 | 713.2 |
NH3的熔、沸点均高于PH3的原因是__________;PH3的分解温度高于其沸点,其原因是__________。
(4)根据价层电子对互斥理论,氨分子中的键角__________(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为__________。
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:

①经过计算,该晶体的化学式是__________。
②该晶体中__________(填“是”或“否”)存在配位键。
-
[化学-选修3:物质结构与性质]
氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。
请回答下列问题:
(1)与氧同周期的相邻元素中,第一电离能由大到小的顺序为_______________。
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构如下图)。

1mol3-MBT中含有σ键数目为_______________(NA为阿伏伽德罗常数的值)。沸点:3-MBT____________(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是___________________。
(3)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是_____________(填选项字母)。
| A.中心原子的价层电子对数目相等 |
| B.都是极性分子 |
| C.中心原子的孤对电子数目相等 |
| D.都含有极性键 |
②SO3分子的空间构型为________,与其互为等电子体的阴离子为_____________(举一例)。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______。

(4)元素X与硒同周期,X元素原子核外未成对电子数最多,X为________(填元素符号),X的基态原子的电子排布式为_______。
(5)单质钋是由_____键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为_________g/cm3
-
选考【化学——选修3:物质结构与性质】(15分)四种常见元素的性质或结构信息如F表所示,请问答下列问题。

(1)R的基态原子价层电子排布式为________,这四种元素的第一电离能由大到小的顺序为________________(写元素符号)。
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为_______,任意写出一种中心原子存在 两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。
两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中 键之比为________,已知有下列两种数据:
键之比为________,已知有下列两种数据:

请解释键能大小与两种氧化物熔点、沸点高低差异过大的原因________。
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为________。

(5)A元素能形成组成为 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是________(填“极性”或“非极性”)分子,
②P的结构简式为________(AH3配体作为一个整体写)。
-
[化学——选修3:物质结构与性质]
H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题:
(1)N、O、Na原子第一电离能由小到大的顺序是 (用元素符号和“<”表示);Cu原子的特征电子轨道式为 。
(2)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是_____;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为 ,水分子与铜离子间结合的化学键名称为 。
(3)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是_____(填序号):①H3O+ 、②H2O、 ③NO2+ 、④NO2- 。
(4)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 ,1个分子中含有____个 键;(CN)2称为“拟卤素”,具有类似Cl2的化学性质,则(CN)2与NaOH水溶液反应的化学方程式为 。
键;(CN)2称为“拟卤素”,具有类似Cl2的化学性质,则(CN)2与NaOH水溶液反应的化学方程式为 。
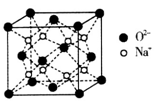
(5)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为___________;已知该晶胞的密度为 ,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用含
,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用含 、NA的代数式表示)。
、NA的代数式表示)。



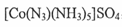 ,该配合物中心离子的配位数为
,该配合物中心离子的配位数为













 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。