-
氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途。
(1)基态砷原子的核外电子排布式为________。氮、磷、砷的第一电离能顺序为__________>__________>__________(填元素符号)。
(2)已知N2O为直线形结构,结构式为N=N=O。则N2O是__________(填“极性”或“非极性”)分子。中间的氮原子的杂化轨道类型为__________杂化。
(3)已知下列数据:
| 物质 | 熔点/K | 沸点/K | 分解温度/K |
| NH3 | 195.3 | 239.7 | 1073 |
| PH3 | 139.2 | 185.4 | 713.2 |
NH3的熔、沸点均高于PH3的原因是__________;PH3的分解温度高于其沸点,其原因是__________。
(4)根据价层电子对互斥理论,氨分子中的键角__________(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为__________。
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:

①经过计算,该晶体的化学式是__________。
②该晶体中__________(填“是”或“否”)存在配位键。
-
化合物ZYX4是在化工领域有着重要应用价值的离子化合物,电子式如图所示。X、Y、Z是原子序数依次增大的短周期元素,其中只有一种为金属元素,X是周期表中原子半径最小的元素。下列叙述中错误的是 ( )

A.Z是短周期元素中金属性最强的元素
B.Y的最高价氧化物对应水化物呈弱酸性
C.X、Y可以形成分子式为YX3的稳定化合物
D.化合物ZYX4有强还原性
-
氮、磷、砷等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
⑴基态砷原子中能量最高的能级为________,下列有关表示基态氮原子的排布图中,仅违背洪特规则的是________。
A.
B.
C.
D.
⑵肼是一种良好的火箭发射燃料,传统制备肼的方法是NaClO + 2NH3 = N2H4 + NaCl + H2O,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
①氮、氧、钠三种元素的第一电离能由大到小的顺序为________。
②N2H4中氮原子的杂化轨道类型为________,H2O的分子构型为________。
③NH3、H2O两分子中心原子杂化类型相同,但水分子中键角比NH3中的键角小,其原因是________________________________________,导致肼与氨气熔点、沸点差异最主要的原因是______________________________________________________________。
⑶有“半导体贵族”之称砷化镓晶体中,As、Ga原子最外电子层均达到8电子稳定结构,则该晶体中的化学键的类型有________。
A. 离子键 B. 极性键 C. 配位键 D.  键
键
⑷由氮、铂(Pt)两元素形成的某种二元化合物的晶胞如图所示,则该化合物的化学式________,若该晶胞的边长为d pm,则该晶体的密度为________ g∙cm-3。

-
碳是形成化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳原子核外电子有_____种不同的运动状态。碳原子的价电子在形成sp3杂化后,其轨道表达式为_____。
(2)写出一种CO32-的等电子体微粒的化学式_______,其空间构型为_______。
(3)有机物M(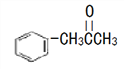 )在一定条件下生成N(
)在一定条件下生成N(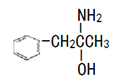 )。
)。
①沸点:M_____N (填“大于”或“小于”)。
②M中碳原子杂化类型为_____,不同杂化类型的碳原子数之比为_____。
③有机物N中除氢原子之外的其他原子的第一电离能由大到小的顺序为_____。
(4)已知CaCO3的热分解温度为900℃,SrCO3的热分解温度为1172℃,试从原子结构的角度解释CaCO3的热分解温度低于SrCO3的原因_____________。
(5)碳的一种同素异形体C60,又名足球烯,是一种高度堆成的球碳分子。立方烷(分子式:C8H8, )是比C60约早20年合成出的一种对称性烃类分子,而如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为______________。
)是比C60约早20年合成出的一种对称性烃类分子,而如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为______________。

(6)石墨是碳的一种同素异形体,它的一种晶胞结构和部分晶胞参数如下图:
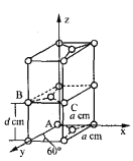
①原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为:A(0,0,0)、B(0,1,1/2)。则C原子的坐标参数为_______________。
②晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm ,层间距为dcm,阿伏加德罗常数的值为NA,则石墨的密度为_____g·cm-3(写出表达式即可)。
-
碳是形成化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳原子核外电子有_____种不同的运动状态。碳原子的价电子在形成sp3杂化后,其轨道表达式为_____。
(2)写出一种CO32-的等电子体微粒的化学式_______,其空问构型为_______。
(3)有机物M( )在一定条件下生成N(
)在一定条件下生成N(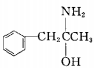 )。
)。
①沸点:M_____N (填“大于”或“小于”)。
②M中碳原子杂化类型为_____,不同杂化类型的碳原子数之比为_____。
③有机物N中除氢原子之外的其他原子的第一电离能由大到小的顺序为_____。
(4)已知CaCO3的热分解温度为900℃,SrCO3的热分解温度为1172℃,试从原子结构的角度解释CaCO3的热分解翻度低于SrCO3的原因_____________。
(5)石墨是碳的一种同素异形体,它的一种晶胞结构和部分晶胞参数如下图:

①原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为:A(0,0,0)、B(0,1,1/2)。则C原子的坐标参数为_______________。
②晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为am ,层间距为dcm,阿伏加德罗常数的值为NA,则石墨的密度为_____g·cm-3(写出表达式即可)。
-
氮元素十分重要,其单质及其化合物在科研、生产领域有着十分广泛的用途。
(1)氮元素核外电子排布式为: ,原子核外共有 种不同能级的电子,氮原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
(2)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化 B.通入大量稀有气体能提高反应的速率
C.容器中气体的密度不随时间而变化 D. (N2)/
(N2)/  (O2)=2:3
(O2)=2:3
(4)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解,反应的化学方程式4NH4ClO4 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
-
碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为______________________。
(2)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵[NH4(OCN)]转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是___________。有机物M(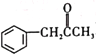 )在一定条件下生成N(
)在一定条件下生成N( )
)
①沸点:M___________N(填“大于”或“小于”)。
②M中碳原子的杂化类型为___________,不同杂化类型的碳原子数之比为___________。
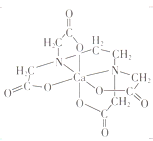
(3)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。该配离子的配位数是___________,配体中碳原子的杂化方式有_________。
(4)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用实线标出了石墨的一个六方晶胞。
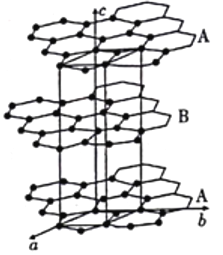
①石墨中C原子上未参与杂化的所有p轨道相互平行且重叠,使p轨道中的电子可在整个碳原子平面中运动而导电。六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,而六方BN却无法导电,其原因是___________。
②晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。
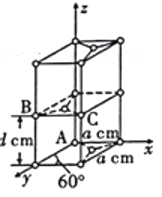
a.原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1, ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
b. 晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm,层间距为 d cm,阿伏加德罗常数的值为NA,则石墨的密度为___________g·cm-3(写出表达式即可)
-
【化学一选修3:物质结构与性质】由N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态Ni原子的最外层电子排布式为_____________________。
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过
3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个(HB=NH)3分子中有__________个 键。
键。
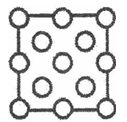
(3)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________。右图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置。
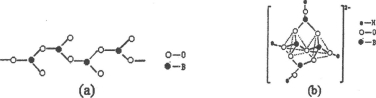
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________,图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。

(5)在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密置单层排列,镍离子填充其中,氧离子的半径为a pm,则每平方米面积上分散的该晶体的质量为_________g(用a、NA表示)
-
铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
(1)基态铁原子的价电子轨道表示式为__。铁、铬、锰属于周期表中的___区元素。
(2)基态铬原子和基态锰原子中第一电离能较大的是___(填元素符号),原因为___。
(3)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgC1沉淀的物质的量之比为3:2:1。
①呈暗绿色的配合物内界的化学式为___。
②H2O分子的VSEPR模型为___。
(4)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为___。
(5)一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。
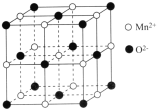
①该晶胞中由O2-形成的正八面体空隙数目为__。
②设NA为阿伏加德罗常数的值,晶胞中距离最近的两个O2-之间的距离为apm,则MnO晶体的密度ρ=____g·cm-3。(用含a、NA的代数式表示)。
-
“张亭栋研究小组”受民间中医启发,发现As2O3对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)为第VA族元素,该族元素的化合物在研究和生产中有着许多重要用途。
(1)N原子的价电子排布式为______,N、P、As原子的第一电离能由大到小的顺序为______。
(2)NH3的沸点比AsH3的沸点高,原因是____________。
(3)立方氮化硼晶体(BN),是一种超硬材料,有优异的耐磨性,其晶胞如图所示。
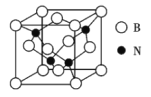
①立方氮化硼是_________晶体,晶体中N原子的杂化轨道类型为_________,A,B原子的配位数为_________。
②立方氮化硼晶体中“一般共价键”与配位键的数目之比为_________。
(4)若立方氮化硼晶胞的边长为362 pm,则立方氮化硼的密度为_________g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。






 )在一定条件下生成N(
)在一定条件下生成N( )。
)。

 )在一定条件下生成N(
)在一定条件下生成N( )。
)。
 )在一定条件下生成N(
)在一定条件下生成N( )
)






