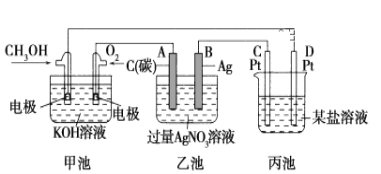
-
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )
A.Y原子的价层电子排布式为3s23p5
B.稳定性:Y的氢化物>Z的氢化物
C.第一电离能:Y<Z
D.X、Y两元素形成的化合物为离子化合物
难度: 中等查看答案及解析
-
中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮。这种“碱剂”主要成分可能是( )
A.氢氧化钾 B.次氯酸钙 C.烧碱 D.碳酸钾
难度: 简单查看答案及解析
-
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
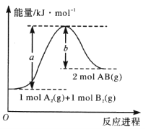
A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ • mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加
B.设NA为阿伏加德罗常数的值,0.5mol/L氯化铁溶液中Fe3+的数目小于0.5NA
C.常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12
D.2.8g铁与0.05molCl2充分反应,转移0.1NA电子
难度: 中等查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A.实验室中常用排饱和食盐水的方法收集Cl2
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.合成氨控制在500℃左右的温度
D.氨水中加酸,NH4+的浓度增大
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是( )
A.
=1012的溶液中:NH4+、Cu2+、NO3-、SO42-
B.滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、SO42-
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
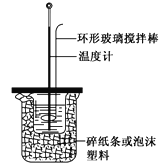
A. 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
D. 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
反应N2(g)+3H2(g)
2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开H-H键的数目和生成N-H键的数目相等
D. 容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
难度: 简单查看答案及解析
-
在体积都为1L、pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下列各图所示内容比较符合客观事实的是
A.
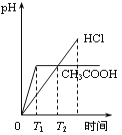 B.
B.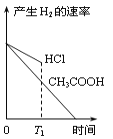 C.
C.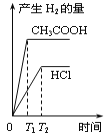 D.
D.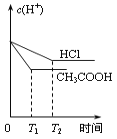
难度: 中等查看答案及解析
-
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
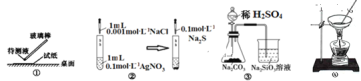
A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
难度: 简单查看答案及解析
-
下列有关实验操作描述正确的是( )
A.在沸水中分别滴加浓氢氧化钠、氯化铁溶液,可制备氢氧化铁胶体
B.用容量瓶配溶液时,若加水超过刻度线,立即用胶头滴管吸出多余液体
C.酸式滴定管装标准液前,必须先用该溶液润洗
D.常见试纸:石蕊试纸、pH试纸、KI淀粉试纸在使用前均需润湿
难度: 中等查看答案及解析
-
己知重铬酸钾在水溶液中存在如下平衡:2CrO42-(黄色)+2H+
Cr2O72-(橙红色)+H2O。下列说法正确的是
A. 当溶液的pH降低时,平衡向左移动
B. 恒温下,将上述溶液用蒸馏水稀释到原体积的2倍,平衡向右移动
C. 当溶液颜色不变时,溶液的c(H+)/c(OH-)是一个定值
D. 增大CrO42-浓度,平衡向右移动,平衡常数增大
难度: 中等查看答案及解析
-
如图所示,a、b、c、d均为石墨电极,通电进行电解,下列说法正确的是( )

A. 电路中电子流向:负极→d→c→b→a→正极
B. a、c两极产生气体的物质的量相等
C. SO42-向b电极运动,Cl-向c电极运动
D. 通电后乙烧杯滴入酚酞溶液d极会变红
难度: 中等查看答案及解析
-
常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
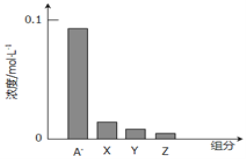
A.该混合溶液中c(HA)+c(A-)=c(Na+)
B.该混合液pH=7
C.图中x表示HA,Y表示OH-,Z表示H+
D.HA是强酸
难度: 中等查看答案及解析
-
已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,将AgCl与AgI的饱和溶液等体积混合,再向混合液中加入足量的浓硝酸银溶液,充分反应,下列说法正确的是( )
A.混合液中只有AgI沉淀生成
B.常温下,AgCl在NaCl溶液中的溶解度与在纯水中的溶解度相同
C.混合液中生成AgCl沉淀物质的量多于AgI沉淀
D.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小
难度: 中等查看答案及解析
-
在25mL0.1mol∙L-1NaOH溶液中逐滴加入0.1mol∙L-1CH3COOH溶液,曲线如图所示,有关粒子浓度关系不正确的是( )
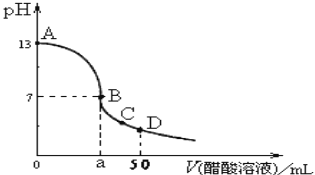
A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH−)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
难度: 困难查看答案及解析