-
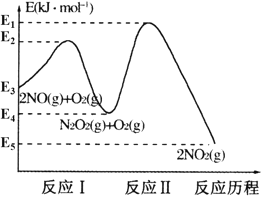
室温下,1 L含0.1 mol CH3COOH和0.1 mol CH3COONa的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变):
溶液a
通入0.01 mol HCl
加入0.01 mol NaOH
pH
4.76
4.67
4.85
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法不正确的是
A.溶液a和 0.1 mol·L−1 CH3COOH溶液中CH3COOH的电离程度前者小于后者
B.向溶液a中通入0.01 mol HCl时,CH3COO−结合H+生成CH3COOH,pH变化不大
C.向溶液a中加入0.1 mol NaOH固体,pH基本不变
D.含0.1 mol·L−1 NH3·H2O与0.1 mol·L−1 NH4Cl的混合溶液也可做缓冲溶液
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法正确的是( )
A.抗病毒疫苗通常需在高温下贮运
B.油脂、纤维素、核酸均是高分子化合物
C.医用消毒酒精中乙醇的体积分数为95%
D.次氯酸钠等含氯消毒剂可用于杀死新冠病毒是因为它们都能使蛋白质变性
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.18g重水(D2O)所含电子的数目为10NA
B.6.4gS2、S4、S6的混合物中所含硫原子的数目为0.2NA
C.标准状况下,2.24LHF中分子的数目为0.1NA
D.60g乙酸与足量乙醇发生酯化反应时断裂C—O键的数目为NA
难度: 困难查看答案及解析
-
下列说法中正确的是( )
A.铝的第一电离能比镁的第一电离能大
B.同一主族元素从上到下电负性逐渐变大
C.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
D.最外层电子数是核外电子总数
的原子和最外层电子排布式为4s24p5的原子是同种元素原子
难度: 简单查看答案及解析
-
螺环化合物(
)可用于制造生物检测机器人,下列有关该化合物的说法错误的是( )
A.分子式为C5H8O
B.是环氧乙烷(
)的同系物
C.该螺环化合物的二氯代物有3种以上的同分异构体(不考虑空间异构)
D.所有碳原子不处于同一平面
难度: 中等查看答案及解析
-
Li—SOCl2电池是迄今具有最高能量比的电池。该电池的电极材料分别为锂和碳,电解液(熔点-110℃、沸点78.8℃)是LiAIC14—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCi+S+SO2。下列说法错误的是( )
A.该电池可以在寒冷的地区正常工作
B.该电池工作时,正极反应为:2SOCl2+4e-==4C1-+S+SO2
C.SOC12分子的空间构型是平面三角形
D.该电池组装时,必须在无水无氧条件下进行
难度: 困难查看答案及解析
-
下列图示与对应叙述相符的是
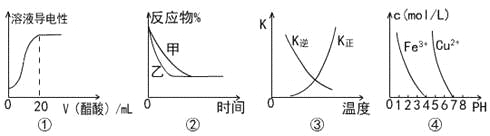
A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g)
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
难度: 中等查看答案及解析
-
一种新型漂白剂结构如图所示,其中W.Y.Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列说法正确的是
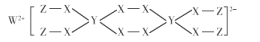
A.非金属性:X>W>Y
B.Y的最高价氧化为对应的水化物为三元酸
C.可利用W与X、Y形成的化合物热还原制备单质Y
D.该漂白剂中仅有X均满足8电子稳定结构
难度: 中等查看答案及解析
-
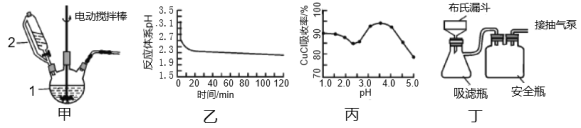
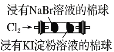
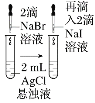
由下列实验现象一定能得出相应结论的是
选项
A
B
C
D
装置或操作
取两支试管各加入4 mL 0.01 mol/L的草酸溶液,分别滴加2 mL 0.1 mol/L、0.2 mol/L的高锰酸钾溶液
向分别盛有5 mL 0.1 mol/L的硫代硫酸钠溶液的试管中滴加5 mL 0.1 mo/L的硫酸溶液,一段时间后,分别放在冷水和热水中。
现象
褪色并观察褪色的时间
左边棉球变黄,右边棉球变蓝
试管中先出现淡黄色固体,后出现黄色固体
试管中液体变浑浊且热水中首先出现浑浊
结论
其他条件不变时,反应物浓度越大,反应速率越快
氧化性:Cl2>Br2>I2
溶解度:AgCl>AgBr>AgI
不能说明温度越高,速率越快
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
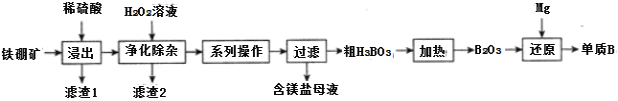
钨是高熔点金属,工业上用主要成分为FeWO4和MnWO4的黑钨铁矿与纯碱共熔冶炼钨的流程如下,下列说法不正确的是( )
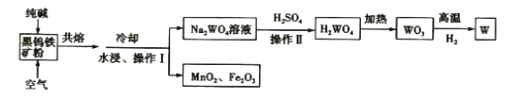
A.将黑钨铁矿粉碎的目的是增大反应的速率
B.共熔过程中空气的作用是氧化Fe(II)和Mn(II)
C.操作II是过滤、洗涤、干燥,H2WO4难溶于水且不稳定
D.在高温下WO3被氧化成W
难度: 中等查看答案及解析
-
已知溶解度也可用物质的量浓度表示,25℃时,Ag2CrO4在不同浓度CrO42-溶液中的溶解度如图所示。又知Ksp(AgCl)=1.8×10-10。下列说法正确的是

A.图中a、b两点c(Ag+)相同
B.该温度下,Ag2CrO4溶度积的数量级为10-12
C.加热蒸发饱和Ag2CrO4溶液再恢复到25℃,可使溶液由a点变到b点
D.将0.01 mol/L AgNO3溶液滴入20 mL 0.01 mol/L KCl和0.01 mol/L K2CrO4的混合溶液中,CrO42-先沉淀
难度: 中等查看答案及解析
-
如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为2K2S2+KI3
K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是
( )
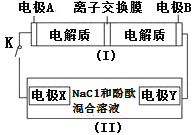
A.闭合K时,K+从左到右通过离子交换膜
B.闭合K时,电极X是阳极
C.闭合K时,电极A的反应式为3I--2e-=I3-
D.闭合K时,当有0.1molK+通过离子交换膜,X电极上产生气体2.24L
难度: 中等查看答案及解析
-
胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
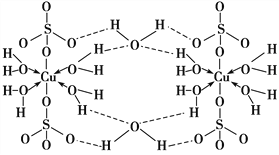
下列有关胆矾的说法正确的是( )
A.所有氧原子都采取sp3杂化 B.氧原子参与形成配位键和氢键两种化学键
C.Cu2+的价电子排布式为3d84s1 D.胆矾中的水在不同温度下会分步失去
难度: 困难查看答案及解析
-
溶液中除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。如图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法不正确的是( ){已知25℃,Ksp[Fe(OH)3]=2.64×10-39}
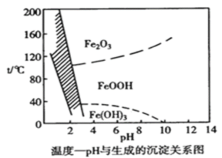
A.在25℃时溶液经氧化,调节溶液pH=4,此时溶液中c(Fe3+)=2.64×10-9mol·L-1
B.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
C.pH=6,温度从80℃升高至150℃体系得到的沉淀被氧化
D.工业生产黄铁矾钠,温度控制在85~95℃pH=1.5左右
难度: 中等查看答案及解析