-
化学与环境、生产、生活关系密切,下列说法正确的是
A.84消毒液和医用酒精都可以起到杀菌消毒的作用,其作用原理相同
B.防控新冠病毒所用的酒精,其浓度越大,杀毒效果越好。
C.工业上常用高纯硅制造光导纤维
D.推广使用可降解塑料及布质购物袋,以减少“白色污染”
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数值,下列叙述中正确的
A.0.4 mol NH3与0.6 mol O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
B.C60和石墨的混合物共1.8 g,含碳原子数目为0.15NA
C.1 L 0.1 mol/LNH4Al(SO4)2溶液中阳离子总数小于0.2NA
D.5.6 g铁在足量的O2中燃烧,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Y单质反应产生常见的还原性气体单质E。下列说法正确的是
A.X、Y、Q对应简单离子的半径逐渐减小
B.工业上可用电解X、Q元素组成的化合物的饱和溶液制备Q单质
C.Y、Q形成的化合物是非电解质
D.工业用W与Z的最高价氧化物反应制取Z单质,同时得到W的最高价氧化物
难度: 中等查看答案及解析
-
1,1-二环丙基乙烯(
)是重要医药中间体,下列关于该化合物的说法正确的是
A.所有碳原子可能在同一平面 B.乙苯与它互为同分异构体
C.二氯代物有9种 D.只能发生取代、加成、加聚反应
难度: 中等查看答案及解析
-
从下列事实所得出的相应结论正确的是
实验事实
结论
A
在相同温度下,向1 mL0.2 mol/LNaOH溶液中滴入2滴0.1 mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀
溶解度:Mg(OH)2>Fe(OH)3
B
某气体能使湿润的蓝色石蕊试纸变红
该气体水溶液一定显碱性
C
同温同压下,等体积pH=3的HA和HB两种酸分别于足量的锌反应,排水法收集气体,HA放出的氢气多且反应速率快
HB的酸性比HA强
D
SiO2既能与氢氟酸反应又能与碱反应
SiO2是两性氧化物
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39 kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46 kJ/mol
H2(g)+
O2(g)=H2O(l) ΔH=-285.84 kJ/mol
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
A.-319.68 kJ/mol B.-417.91 kJ/mol
C.-448.46 kJ/mol D.+546.69 kJ/mol
难度: 中等查看答案及解析
-
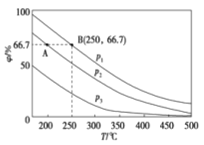
已知:p[
]=-lg[
]。室温下,向0.10 mol/L HX溶液中滴加0.10 mol/LNaOH溶液,溶液pH随p[
]变化关系如图所示。下列说法正确的是
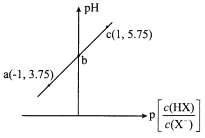
A.溶液中水的电离程度:a>b>c
B.c点溶液中:c(Na+)=10c(HX)
C.室温下NaX的水解平衡常数为10-4.75
D.图中b点坐标为(0,4.75)
难度: 中等查看答案及解析