-
化学与生活密切相关,下列应用中一定发生了氧化还原反应的是
A.氯气作自来水的消毒剂
B.食醋除去水壶的水垢
C.二氧化硫漂白草帽
D.石膏点豆腐
难度: 简单查看答案及解析
-
某有机物能发生水解反应,其结构简式为CH3—CO—R,则—R可能是
A.—OH B.一CH3 C.—H D.—O—CH3
难度: 简单查看答案及解析
-
糖类、油脂及蛋白质是基本营养物质。下列说法正确的是
A.都是高分子化合物
B.均只含C、H、O三种元素
C.油脂发生皂化反应后可以制得肥皂
D.在人体中消耗相同质量的上述三种物质时,蛋白质产生的能量最高
难度: 简单查看答案及解析
-
下列离子不能大量共存的是
A.NH4+、Fe3+、S
、N
B.Na+、Ca2+、
、C
C.K+、Na+、S
、
D.K+、Na+、
、N
难度: 简单查看答案及解析
-
为提纯下列物质(括号内为杂质),所选试剂及方法均正确的是
选项
物质
除杂试剂
方法
A
溴苯(溴)
CCl4
分液
B
NH3(H2O)
浓硫酸
洗气
C
乙烷(乙烯)
溴水
洗气
D
CO2(SO2)
Na2CO3饱和溶液
洗气
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知
、
时,强酸与强碱的稀溶液发生中和反应生成
水放出的热量为
,则下列描述正确的是
A.酸碱中和反应的中和热为
B.
C.
强酸和
强碱完全反应,放出的热量一定为
D.稀盐酸与稀氨水反应生成
水,放出的热量小于
难度: 简单查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A.酸性:
B.热稳定性:Na2 CO3
NaHCO3
C.与水反应的速率:Na
Mg
D.非金属性:Cl
Br
难度: 简单查看答案及解析
-
下列实验操作正确且能达到实验目的的是
A. 用蒸发皿加热分离Br2和CCl4的混合溶液
B. 将含少量二氧化锰的炭粉放在坩埚中灼烧除去二氧化锰
C. 配制Hg(NO3)2溶液时,将Hg(NO3)2溶于较浓硝酸中,然后加水稀释
D. 制取并纯化SO2时,将Na2SO3和70%的硫酸混合加热,将产生的气体依次通过饱和Na2SO3溶液、浓硫酸
难度: 中等查看答案及解析
-
反应mA(g)+nB(g)=eC(g)+fD(s) △H。若按反应物的化学计量数比投料,在一定条件下进行反应,该反应达到平衡时C的气体体积分数与温度、压强的关系如图所示。下列叙述正确的是
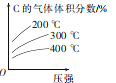
A.该反应的△H >0
B.该化学方程式中m+n>e+f
C.加入催化剂可加快正反应速率,逆反应速率不变
D.往平衡后的恒压容器中再充入一定量C,达到新平衡时,C的浓度与原平衡时的相同
难度: 简单查看答案及解析
-
苹果酸首先是从苹果汁中分离出来的,是苹果汁酸味的来源,并因此得名,存在于苹果、葡萄、山楂等果实中。它也用作食品添加剂,能发生如图转化,下列有关说法正确的是
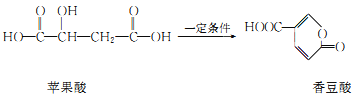
A.苹果酸和香豆酸均能与溴水发生加成反应
B.香豆酸的分子式为C6H6O4
C.苹果酸、香豆酸均含三种官能团
D.苹果酸、香豆酸均能与NaHCO3反应
难度: 简单查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期主族元素,且原子核外L层的电子数分别为O、5、8、8,其最外层电子数之和为18。下列说法正确的是
A.XW3为分子晶体 B.第一电离能:Y>X
C.化合物WZ难溶于水 D.由Y与Z形成的所有化合物均满足8电子稳定结构
难度: 中等查看答案及解析
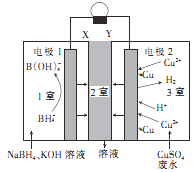
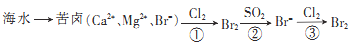
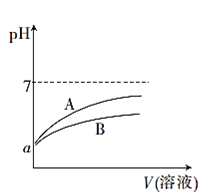


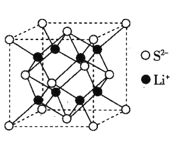
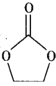 )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。