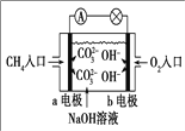
-
下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A.
 反应开始后,针筒活塞 向右移动
反应开始后,针筒活塞 向右移动B.
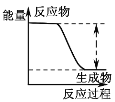 反应物总能量大于生 成物总能量
反应物总能量大于生 成物总能量C.
 反应开始后,甲处液面 低于乙处液面
反应开始后,甲处液面 低于乙处液面D.
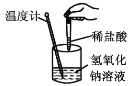 温度计的水银柱不断 上升
温度计的水银柱不断 上升难度: 简单查看答案及解析
-
2A(g)
B(g) ΔH1(ΔH1<0); 2A(g)
B(l) ΔH2;下列能量变化示意图正确的是
A.
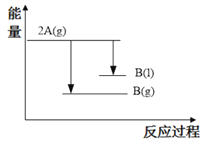 B.
B.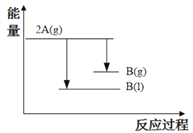
C.
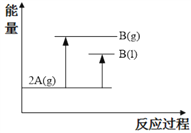 D.
D.
难度: 中等查看答案及解析
-
在一容积可变的密闭容器中加入WO3和H2进行反应WO3(s)+3H2(g)
W(s)+3H2O(g),下列说法不正确的是
A.增加H2O(g)的量,消耗H2的速率瞬间不变
B.将容器的体积缩小一半,其反应速率加快
C.保持体积不变,充入氩气,其反应速率不变
D.保持压强不变,充入氖气,H2O(g)生成速率减慢
难度: 中等查看答案及解析
-
某同学用如图所示实验来探究构成原电池的一般条件,下列说法中正确的是
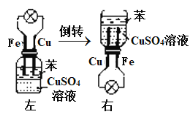
A.左瓶的灯泡发光
B.右瓶的铜棒变粗
C.右瓶中铁棒为正极
D.左瓶:Fe−2e−===Fe2+
难度: 简单查看答案及解析
-
根据能量变化示意图,下列热化学方程式正确的是( )

A.N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1
B.N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1
C.2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1
D.2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1
难度: 中等查看答案及解析
-
X、Y、Z、W 是四种原子序数依次增大的短周期元素,W 的最外层电子数比 X 的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2 的结构式如图所示。下列说法错误的是
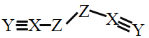
A.化合物 WY 是良好的耐热冲击材料
B.Y的氧化物对应的水化物可能是弱酸
C.Y的简单氢化物的沸点一定高于 Z
D.化合物(ZXY)2 中所有原子均满足 8 电子稳定结构
难度: 中等查看答案及解析
-
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下以下结论错误的是( )

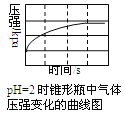

A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁不可能发生吸氧腐蚀
C.吸氧腐蚀的速率比析氢腐蚀快
D.两溶液中负极反应均为:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
在一定条件下,测得2CO2
2CO+O2(反应从CO2开始)平衡体系的平均相对分子质量为M,在此条件下,CO2的分解率为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
有关如图所示装置的叙述正确的是( )
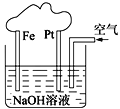
A.溶液中Na+向Fe极移动
B.该装置中Pt为正极,电极反应为:O2 + 2H2O + 4e−=4OH−
C.该装置中Fe为负极,电极反应为:Fe−2e−=Fe2+
D.该原电池装置最终的产物是Fe(OH)2
难度: 简单查看答案及解析
-
下列装置或操作能达到目的的是
A.
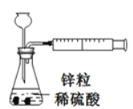 装置用于测定生成氢气的速率
装置用于测定生成氢气的速率B.
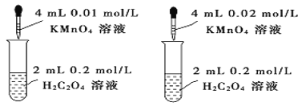 装置依据单位时间内颜色变化来比较浓度对反应速率的影响
装置依据单位时间内颜色变化来比较浓度对反应速率的影响C.
 装置依据 U 型管两边液面的高低判断钠和水反应的热效应
装置依据 U 型管两边液面的高低判断钠和水反应的热效应D.
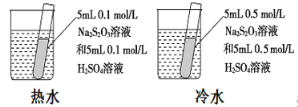 装置依据出现浑浊的快慢比较温度对反应速率的影响
装置依据出现浑浊的快慢比较温度对反应速率的影响难度: 中等查看答案及解析
-
将一定量纯净的 A 置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:A(s)
2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
A.v 正(B)=2v 逆(C) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中气体 B 的体积分数不变
难度: 中等查看答案及解析
-
各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
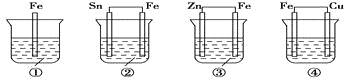
A.④②①③ B.④③①② C.②①③④ D.③②④①
难度: 中等查看答案及解析
-
下列各物质中,除氢原子外,每个原子最外层均达到8电子结构,则它们的结构式错误的是( )
A.氧分子:O=O
B.S2Cl2:Cl-S-S-Cl
C.氢氰酸:H-C
N
D.光气(COCl2):Cl-C-O-Cl
难度: 简单查看答案及解析
-
有甲、乙一起做了水果电池实验,测得数据如下表,甲问,乙答,不正确的是( )
实验次数
电极材料
水果品种
电极间距/cm
电压/mV
1
锌
铜
菠萝
3
900
2
锌
铜
苹果
3
650
3
锌
铜
柑橘
3
850
4
锌
铜
西红柿
3
750
5
锌
铝
菠萝
3
650
6
锌
铝
苹果
3
450
①甲:实验6中的负极反应如何写?
乙:铝为负极:Al-3e-===Al3+
②甲:实验1、5电流方向为什么相反?
乙:实验1中锌为负极,电子由锌经溶液流向铜;实验5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关?
乙:只跟水果的品种有关;
④甲:水果电池中的铜电极可以用硬币代替吗?
乙:可以。
A.③④ B.②③ C.①②③ D.②③④
难度: 中等查看答案及解析
-
X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A.Q的氧化物一定含有离子键和共价键 B.最高价含氧酸的酸性:Z<Y
C.P的最低价氢化物常温常压下为液体 D.Y形成的化合物种类最多
难度: 中等查看答案及解析
-
短周期主族元素 W、X、Y、Z 的原子序数依次增大,W 的简单氢化物可用作制冷剂, Y 的原子半径是所有短周期主族元素中最大的。由 X、Y 和 Z 三种元素形成的一种盐溶于 水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A.X 的简单氢化物的热稳定性比 W 强
B.Y 的简单离子与 X 的具有相同的电子层结构
C.氧化物水化物的酸性 W>Z
D.Z 与 X 属于同一主族,与 Y 属于同一周期
难度: 中等查看答案及解析
-
把下列 4 种X的溶液分别加入 4 个盛有 10 mL 2 mol/L 盐酸的烧杯中,均加水稀释到50 mL,此时X与盐酸缓和地进行反应。其中反应速率最大的是
A.20 mL 3 mol/L 的X溶液 B.20 mL 2 mol/L 的X溶液
C.10 mL 4 mol/L 的X溶液 D.10 mL 2 mol/L 的X溶液
难度: 中等查看答案及解析
-
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
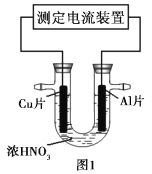
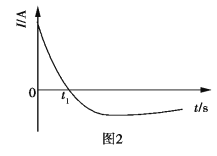
下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是
+2H++e−=NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
难度: 中等查看答案及解析
-
H2和 I2在一定条件下能发生反应:H2(g)+I2(g)
2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
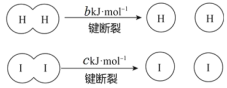
A.反应物的总能量高于生成物的总能量
B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量
C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ
D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ
难度: 中等查看答案及解析
-
X、Y、Z、W 是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,W的原子序数是 Z的两倍,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两种常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色 晶体。下列说法正确的是
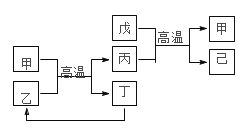
A.W金属性强于 Z
B.W 元素在周期表中的位置是第四周期 VIII 族
C.丙属于两性氧化物
D.等物质的量的甲和戊完全溶于稀硝酸,消耗的 HNO3的量一定相等
难度: 中等查看答案及解析