-
检验SO2中是否混有CO2气体,可采用的方法是( )
A. 通过品红溶液,若品红溶液褪色,则说明混有CO2气体
B. 通过澄清石灰水,若变混浊,则说明混有CO2气体
C. 先通过NaOH溶液,再通过澄清石灰水,若变混浊,则说明混有CO2气体
D. 先通过足量KMnO4溶液(具有强氧化性),再通过澄清石灰水,若变浑浊,则说明CO2气体
难度: 简单查看答案及解析
-
W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是
A. 原子半径大小为W<X<Y<Z
B. X的氢化物水溶液酸性强于Z的
C. Y2W2与ZW2均含有非极性共价键
D. 标准状况下W的单质状态与X的相同
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是 ( )
A.硫原子的原子结构示意图:
 B.质量数为 37的氯原子:
B.质量数为 37的氯原子:C.原子核内有10个中子的氧原子:
O D.NH4Cl的电子式:
难度: 简单查看答案及解析
-
下列物质中,只含有离子键,不含有共价键的是 ( )
A.NH4Cl B.KOH C.CO2 D.CaCl2
难度: 简单查看答案及解析
-
已知铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能发生反应,且有气体、有沉淀产生,则该盐是
A.FeCl3 B.Ba(NO3)2 C.Na2SO4 D.KCl
难度: 中等查看答案及解析
-
下列物质的制取原理错误的是( )
A.金属钠的制取:2NaCl(熔融)
2Na+Cl2↑
B.金属镁的制取:MgO+CO
Mg+CO2
C.金属铬的制取:Cr2O3+2Al
2Cr+Al2O3
D.金属汞的制取:2HgO
2Hg+O2↑
难度: 中等查看答案及解析
-
X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化合物的化学式可能是
A.XYZ B.X3YZ C.XYZ2 D.X2YZ3
难度: 简单查看答案及解析
-
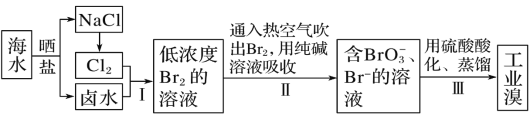
从海水中提取镁,正确的方法是( )
A.海水
Mg(OH)2
Mg
B.海水
MgCl2溶液
MgCl2晶体
Mg
C.海水
Mg(OH)2
MgO
Mg
D.海水
Mg(OH)2
MgCl2溶液
无水MgCl2
Mg
难度: 中等查看答案及解析
-
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶气体是
① CO、O2 ② Cl2、CH4 ③ NO2、O2④ N2、H2
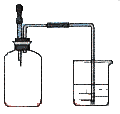
A.①② B.②④ C.③④ D.②③
难度: 中等查看答案及解析
-
下列有机物中互为同分异构体的是( )
①CH2=CHCH3
②
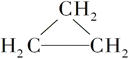
③CH3CH2CH3
④HC≡CCH3
⑤
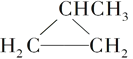
⑥CH3CH2CH2CH3
A.①和② B.①和③ C.①和④ D.⑤和⑥
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.含碳元素的化合物都是有机物
B.完全燃烧只生成CO2和H2O的化合物都是烃
C.大多数有机物分子中碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是非极性共价键和极性共价键
D.有机物完全燃烧只可能生成 CO2和 H2O
难度: 简单查看答案及解析
-
2016年IUPAC命名117号元素为Ts(中文名“
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是
难度: 简单查看答案及解析
-
下列分子中所有原子都能满足最外层为 8 电子结构的是( )
A.CF4 B.H2O C.BCl3 D.PCl5
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是 ( )
A.铜与浓硝酸反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
B.金属铁与稀硝酸反应: Fe + 2H+= Fe2++ H2↑
C.碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O
D.氯气通入氢氧化钠溶液中:Cl2 +2OH-= Cl-+ ClO-+ H2O
难度: 中等查看答案及解析
-
下列说法中正确的一组是( )
A.H2和D2互为同位素
B.
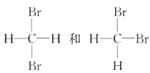 互为同分异构体
互为同分异构体C.正丁烷和异丁烷是同系物
D.
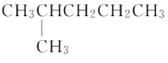 和
和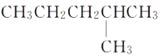 是同一种物质
是同一种物质难度: 中等查看答案及解析
-
短周期元素 W、X、Y、Z 在元素周期表中的位置如图所示,其中Y元素的原子最外层电子数是K层电子数的两倍,下列说法中不正确的是( )
W
X
Y
Z
A.W、Z和氢3种元素可以形成离子化合物
B.Y、Z常见的氢化物的热稳定性:HZ>YH4
C.W的最高价氧化物对应水化物的酸性比Y的强
D.原子半径大小:Y>Z>X>W
难度: 简单查看答案及解析
-
在下列变化过程中,既有离子键被破坏又有共价键被破坏的是
A. 将SO2通入水中 B. 烧碱溶于水
C. 将HCl通入水中 D. 硫酸氢钠溶于水
难度: 简单查看答案及解析
-
①~⑥是周期表中第二、三周期的元素,它们的主要化合价和原子半径如下表所示:
元素
①
②
③
④
⑤
⑥
主要化合价
+1
+1
+2
-2
-1
-1、+7
原子半径/nrn
0.152
0.186
0.160
0.074
0.071
0.099
下列说法不正确的是
A. ①的单质加热时能与氧气化合 B. ②的单质常温下可与水剧烈反应
C. ③与⑥可以形成离子化合物 D. 非金属性④>⑤
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.共价化合物中可能含离子键
B.离子化合物中可能含共价键
C.非金属原子间不可能形成离子键
D.非极性键只存在于双原子单质分子里
难度: 简单查看答案及解析
-
若R元素原子的质量数为A,Rm-的核外电子数为x,则w g Rm-所含中子的物质的量为( )
A.(A-x+m) mol B.(A-x-m) mol
C.
(A-x+m) mol D.
(A-x-m) mol
难度: 中等查看答案及解析
-
短周期元素的离子aW2+、bX+、cY2-、dZ- 都具有相同的电子层结构,下列推断正确的是
A.原子半径:W>X>Z>Y B.热稳定性: H2Y>HZ
C.离子半径:W2+>Y2- D.碱性:XOH>W(OH)2
难度: 简单查看答案及解析
-
下列事实能判断金属元素甲的金属性一定比乙强的有( )
① 甲单质能与乙盐的溶液反应并置换出乙
② 甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③ 甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④ 甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤ 两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多
A.全部可以 B.仅②可以 C.仅②⑤可以 D.①③④可以
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、M,X、Y、Z在周期表中的位置关系如图,X和Y能形成两种化合物,M 与Y同周期,且M是同周期中原子半径最大的元素。下列说法不正确的是
Z
X
Y
A.X、Y、Z元素的气态氢化物中,Y 的氢化物的沸点最高
B.Z和M 组成的化合物为离子化合物,它与盐酸反应能生成两种盐
C.四种元素简单离子的半径由大到小依次为: Y>Z>X>M
D.含Y 元素的所有18 电子微粒均可与Cl2发生反应
难度: 中等查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
难度: 简单查看答案及解析
-
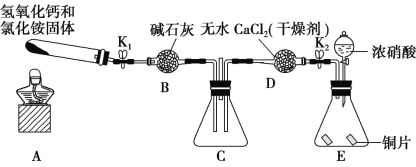
下图是产生和收集气体的实验装置,该装置最适合于
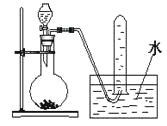
A.用浓硝酸与Cu反应制取NO2
B.用浓盐酸和MnO2反应制取Cl2
C.用NH4Cl和Ca(OH)2反应制取NH3
D.用H2O2溶液和MnO2反应制取O2
难度: 中等查看答案及解析