-
对于300mL1mol/L盐酸与铁片的反应,采取下列措施:
①升高温度 ②改用100mL 3mol/L盐酸
③再加300mL 1mol/L盐酸 ④用等量铁粉代替铁片
⑤改用100mL 98%的硫酸 其中能使反应速率加快的是
A.①②④ B.①③④ C.①②③④ D.①②③⑤
难度: 简单查看答案及解析
-
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( )
A.由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-=Cu2+
B.由Al、Cu、稀硫酸组成原电池,负极反应式为:Cu-2e-=Cu2+
C.由Al、Mg、NaOH溶液组成原电池,负极反应式为:Al+4OH--3e-=AlO2-+2H2O
D.由Al、Cu、浓硝酸组成的原电池中,负极反应式为:Al-3e-=Al3+
难度: 中等查看答案及解析
-
铅蓄电池的两极分别为Pb、PbO2,电解液为硫酸,工作时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下面结论正确的是
A. Pb为正极,被氧化 B. 溶液的pH不断减小
C. SO42-只向PbO2处移动 D. 电解液密度不断减小
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.2.3gNa充分燃烧时转移电子数为0.1NA
B.1molCu和足量热浓硫酸反应,生成SO3的分子数为NA
C.50mL12mol·L-1盐酸与足量MnO2共热,转移电子数为0.3NA
D.标准状况下,2.24LCl2与足量铁粉充分反应转移的电子数为0.3NA
难度: 简单查看答案及解析
-
利用NO、O2和Na2CO3溶液反应制备NaNO2的装置如图所示,下列关于该装置的描述不正确的是( )
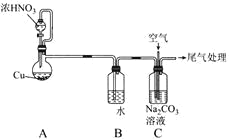
A.装置A分液漏斗中的药品选用不当,应选用稀HNO3
B.实验过程中,通过控制分液漏斗的活塞控制气流速度
C.装置C中发生反应的化学方程式为2Na2CO3+4NO+O2=4NaNO2+2CO2↑
D.实验过程中,装置C液面上方可能出现红棕色气体
难度: 中等查看答案及解析
-
改变反应物用量,下列反应能用同一个反应方程式表示的是( )
①NaAlO2溶液与CO2反应;
②Si与烧碱溶液反应;
③H2S与NaOH溶液反应;
④Fe与稀硝酸反应;
⑤S在O2中燃烧;
⑥N2与O2的反应。
A.②⑤⑥ B.①②⑤ C.①③④ D.③④⑥
难度: 中等查看答案及解析
-
实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说法不正确的是( )
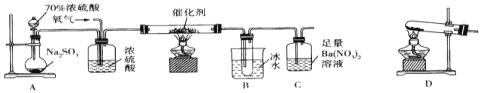
A.A装置烧瓶中发生的反应可以表示为SO32-+2H+=SO2↑+H2O
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
难度: 中等查看答案及解析
-
某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4。某实验小组以该废催化剂为原料,回收锌和铜,设计实验流程如图:
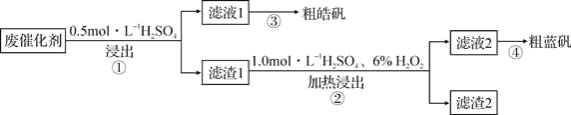
下列说法正确的是( )
A.检验滤液1中是否含有Fe2+,可以选用KSCN和新制的氯水
B.步骤②操作中,应先加6%H2O2,然后不断搅拌下缓慢加入1.0mol/LH2SO4
C.滤渣1成分是SiO2和CuS,滤渣2成分只有SiO2
D.步骤①操作中,生成的气体需用NaOH溶液或CuSO4溶液吸收
难度: 中等查看答案及解析
-
下列判断错误的是
A.稳定性:H2O>H2S>H2Se B.半径:Na+>Mg2+>F-
C.酸性:HClO4>H2SO4>H3PO4 D.碱性:NaOH>Mg(OH)2>Al(OH)3
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。向由X、Y和Z三种元素形成的一种盐中加入浓硫酸,有刺激性气味的气体产生。下列说法不正确的是
A.X的简单氢化物的热稳定性比W强
B.Y的简单离子与X的具有相同的电子层结构
C.X与Z形成化合物可使石蕊试液褪色
D.Z与X属于同一主族,与Y属于同一周期
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中W原子的质子数是其M 层电子数的3倍,下列说法不正确的是( )
X
Y
Z
W
Q
A.X 与Y 可形成的化合物在5种以上
B.工业上常常通过电解Z 的熔融氧化物的方法来获得Z 的单质
C.这五种元素形成的简单离子的半径由大到小的顺序为W>Q>X>Y>Z
D.W、Q两种元素形成的化合物每种原子最外层都达到了8e-稳定结构
难度: 中等查看答案及解析
-
2019年的全国高考与传统节日端午节相遇。端午节习俗之一是喝雄黄酒。雄黄是As4S4,其中元素As的原子序数比S的两倍多1。下列说法正确的是( )
A.气态氢化物稳定性:As>S
B.As元素在周期表中位置为ⅦA族
C.As最高价氧化物对应的水化物为强酸
D.As位于金属与非金属分界线附近
难度: 简单查看答案及解析
-
金刚石和石墨是碳元素的两种结构不同的单质。在100kPa时,1mol石墨转化为金刚石,要吸收1.9kJ的热能。下列说法不正确的是
A. 石墨比金刚石稳定 B. 金刚石和石墨的物理性质相同
C. 1mol金刚石比1mol石墨的总能量高 D. 1mol金刚石完全燃烧释放的能量比1mol石墨完全燃烧释放的能量多
难度: 中等查看答案及解析
-
下列物质间的反应,其能量变化符合下图的是 ( )
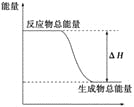
A.铝热反应
B.灼热的炭与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.碳酸钙的分解
难度: 简单查看答案及解析
-
化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化如图所示,则下列说法中正确的是
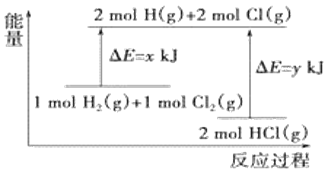
A.该反应是吸热反应
B.断裂1molH-H键和1molCl-Cl键时能放出x kJ的能量
C.断裂2molH-Cl键时需要吸收y kJ的能量
D.2molHCl(g)的总能量高于1molH2(g)和1molCl2(g)的总能量
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是
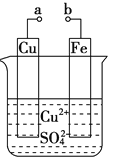
A. a和b不连接时,铁片上会有金属铜析出
B. a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
难度: 中等查看答案及解析
-
某电池总反应为 2Fe3++Cu=2Fe2++Cu2+,不能实现该反应的原电池是
A.电极材料 Fe、Cu,电解质溶液 FeCl3 溶液
B.电极材料石墨、Cu,电解质溶液 Fe2(SO4)3 溶液
C.电极材料 Pt、Cu,电解质溶液 FeCl3 溶液
D.电极材料 Ag、Cu,电解质溶液 Fe2(SO4)3 溶液
难度: 简单查看答案及解析
-
在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)
2NO2(g),若N2O4的浓度由0.1mol·L-1降到0.07mol·L-1需要15s,那么N2O4的浓度由0.07mol·L-1降到0.05mol·L-1所需的反应时间( )
A.等于5s B.等于10s C.小于10s D.大于10s
难度: 简单查看答案及解析
-
反应4A(s)+3B(g)=2C(g)+D(g),经2min后B的浓度减少0.6mol/L。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.4mol/(L·min)
B.用B、C、D分别表示反应的速率,其比值是3:2:1
C.在2min末的反应速率用B表示是0.3mol/(L·min)
D.在这2min内用B和C表示的速率的值都是逐渐增大的
难度: 简单查看答案及解析
-
将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)⇌xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol•L-1•min-1,下列说法正确的是( )
A. 反应速率
B. 该反应方程式中,
C. 2min时,A的物质的量为
D. 2min时,A的转化率为
难度: 简单查看答案及解析