-
《厉害了,我的国》展示了中国在航空、深海、交通、互联网等方面取得的举世瞩目的成就,它们与化学有着密切联系。下列说法正确的是( )
A.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
B.港珠澳大桥使用高性能富锌底漆防腐,依据的是外加电流的阴极保护法
C.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
D.化学材料在北京大兴机场的建设中发挥了巨大作用,其中高强度耐腐蚀钢筋属于无机材料
难度: 简单查看答案及解析
-
下列离子方程式或化学方程式正确的是
A.向A12(SO4)3溶液中滴加Na2S溶液: 2Al3+ +3S2- = Al2S3↓
B.CuSO4 溶液中加入过量NaHS溶液: Cu2++HS- =CuS↓+H+
C.向Na2S2O3溶液中加入稀HNO3: S2O3 2-+2H+=SO2↑+S↓+H2O
D.“侯德榜制碱法”首先需制备碳酸氢钠: NaCl(饱和)+NH3+CO2+H2O= NaHCO3↓+NH4Cl
难度: 中等查看答案及解析
-
有关有机物的说法正确的是
A.1mol
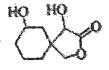 最多能消耗3 mol NaOH,不能与H2加成
最多能消耗3 mol NaOH,不能与H2加成B.辛酸的同分异构体(CH3)3CCH (CH3) CH2COOH的名称为2,2,3-三甲基戊酸
C.1,3,5-三甲苯的二氯代物有5种
D.异丙苯和对甲乙苯互为同系物
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的有
①3lg白磷中含有1.5NA个P-P键
②1L0.1mol·L-1的Na2CO3溶液中所含阴离子的总数目为0.1NA
③标准状况下,22.4LHF 中含有NA个分子
④电解精炼铜时,若转移NA个电子,则阳极溶解32g铜
⑤将2.24L(标准状况)Cl2溶于水,转移的电子数为0.1NA
⑥常温下,含有0.2molH2SO4的浓硫酸与足量铜反应,生成SO2分子的数目小于0.1NA
⑦142gNa2SO4 和Na2HPO4的固体混合物中所含阴、阳离子的总数目为3NA
⑧NA个Fe(OH)3胶体粒子的质量为107g
A.2项 B.3项 C.4项 D.5项
难度: 简单查看答案及解析
-
下列实验中,依据实验操作及现象得出的结论正确的是
选项
操作
现象
结论
A
向3mL0.1mol/LAgNO3溶液中先加入4-5滴0.1mol/L的NaCl溶液,再滴加4-5滴0.1mol/L的NaI溶液
先出现白色沉淀,后出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
B
将某气体通入品红溶液
品红溶液褪色
该气体是SO2
C
相同温度下,用pH试纸测定等浓度的Na2CO3和NaClO溶液的pH
前者颜色深,后者颜色浅
酸性:HClO>HCO3-
D
将铜粉加入1.0mol·L-1Fe2(SO4)3溶液中
溶液变蓝
氧化性Fe3+>Cu2+
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,其中X原子的质子总数与电子层数相等,X、Z同主族,Y、W同主族,且Y、W形成的一种化合物甲是常见的大气污染物。下列说法错误的是
A.简单离子半径: Z<Y<Q<W
B.Y能分别与X、Z、W形成具有漂白性的化合物
C.非金属性: W<Q; W、Q的气态氢化物的水溶液的酸性: W<Q
D.电解Z与Q形成的化合物的水溶液,为了产物的纯度和实验安全,只能使用阴离子交换膜
难度: 简单查看答案及解析
-
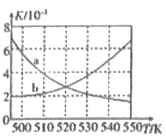
25°C时, 向一定浓度的Na2C2O4溶液中滴加盐酸,混合溶液的pH与离子浓度变化关系如图所示。已知H2C2O4是二元弱酸,X表示
或
下列叙述错误的是
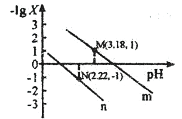
A.直线n表示pH与- lg
的关系
B.从M点到N点的过程中,c(H2C2O4)逐渐增大
C.pH= 4.18的混合溶液中: c(Na+)>c(HC2O4-)= c(C2O42-)=(C1-)> c(H+)> c(OH-)
D.由N点可知Kal(H2C2O4)的数量级为10-2
难度: 简单查看答案及解析
 B.
B.  C.
C. 
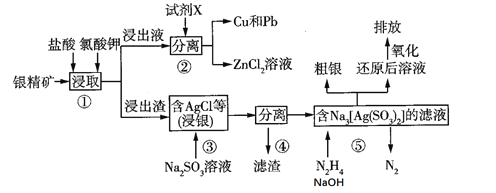
 ,设计由乙醇和
,设计由乙醇和