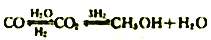-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2) 在催化剂的作用下合成甲醇,可能发生的反应如下:
I.CO(g)+H2O(g) CO2(g)+H2(g) △H1=-41.0kJ/mol
CO2(g)+H2(g) △H1=-41.0kJ/mol
II. CO(g) +2H2(g) CH3OH(g) △H2=-90. 0kJ/mol
CH3OH(g) △H2=-90. 0kJ/mol
III.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
回答下列问题:
(1)则△H3=______,在以上制备甲醇的两个反应中,反应II优于反应III,其原因为______。
(2)一定化例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。

当温度为470K时,图中P点_____(填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是____________。
(3)图2 为一定比例的CO2、H2,CO、H2,CO、CO2、.H2条件下甲醇生成速率与温度的关系。
①490K时,根据曲线a、c 判断合成甲醇的反应机理是______(填“A"或“B").
A.  B.
B. 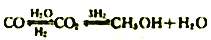
②490K时,曲线a 与曲线b相比,CO的存在使甲醇生成速率增大,结合反应I、III分析原因______________________。
(4)研究证实,CO2 也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式为_____。
-
(14分)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
① CO(g) + 2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
② CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H2
CH3OH(g)+ H2O(g) △H2
③ CO2(g) + H2(g) CO(g) + H2O(g) △H3
CO(g) + H2O(g) △H3
回答下列问题:
(1)已知
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
则△H1= kJ.mol-1
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为 (填曲线标记字母),判断理由是 。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”)原因是 。
图2中的压强由大到小为 ,判断理由是 。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g) CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
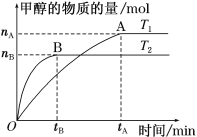
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g) CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
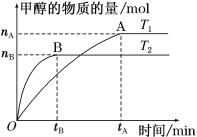
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
-
(1)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
(2)烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
NO(g)+ O2(g)===NO2(g) ΔH=-58.2 kJ·mol-1
O2(g)===NO2(g) ΔH=-58.2 kJ·mol-1
SO2(g)+O3(g)===SO3(g)+O2(g) ΔH=-241.6 kJ·mol-1
则反应3NO(g)+O3(g)===3NO2(g)的ΔH=________kJ·mol-1。
-
甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-58kJ•mol-1
CH3OH(g)+H2O(g) △H2=-58kJ•mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41kJ•mol-1
CO(g)+H2O(g) △H3=+41kJ•mol-1
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:

则x=____________;
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化关系如图中状态I(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。
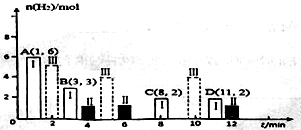
①T℃时状态I条件下,0~3min内CH3OH的平均反应速率v=_______mol/(L·min),平衡常数K=_____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_____;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度_______(填“>”、“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2_______(填“>”、“<”或“=”)K3;
⑤一定温度下同,此反应在恒容容器中进行,能判断该反应达到化学平衡依据的是_______。
a.容器中压强不变
b.甲醇和水蒸汽的体积比保持不变
c.v正(H2)=3v逆CH3OH)
d.2个C=O断裂的同时有6个H—H断裂
-
甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H﹣H | C﹣O | C≡O | H﹣O | C﹣H |
| E/( kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=﹣58 kJ•mol-1,则ΔH3=______。
(2)合成气中的氢气是发展中的新能源,它的利用包括制备、储存和应用三个环节。与汽油相比,氢气作为燃料的优点是__________________________________________________________(写出两点),缺点是______________________________________________________________________(写出两点)。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i CO2(g)+ 3H2(g)  CH3OH(g)+ H2O(g) ∆H1=Q kJ·mol-1
CH3OH(g)+ H2O(g) ∆H1=Q kJ·mol-1
ii. CO2(g)+ H2(g)  CO(g)+H2O(g) ∆H2=+41 kJ·mol-1
CO(g)+H2O(g) ∆H2=+41 kJ·mol-1
iii. CO(g)+2H2(g)  CH3OH(g) ∆H3=− 99 kJ·mol-1
CH3OH(g) ∆H3=− 99 kJ·mol-1
回答下列问题:
(1)Q=_________
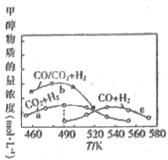
(2)图中能正确反映平衡常数K3(反应iii的平衡常数)随温度变化关系的曲线为__(填字母)
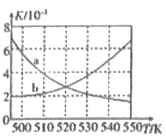
(3)如图为单位时间内CO2+H2、CO+ H2、CO/CO2+H2三个条件下生成甲醇的物质的量浓度与温度的关系(三个条件下通入的CO、CO2和H2的物质的量浓度相同)。490K时,根据曲线a、c判断合成甲醇时主要发生的反应为________(填“i”或“iii”);由曲线a可知,甲醇的量先增大后减小,其原因是_________________________________。
(4)如图是以NaOH溶液为电解质溶液的甲醇燃料电池:电极a的反应式为____________,若隔膜为阳离子交换膜,则每转移6mol电子,溶液中有_______mol Na+向____________(填“正极区”或“负极区")移动。
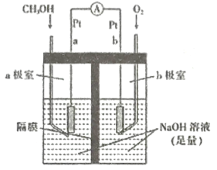
(5)CO2经催化加氢也可以生成低碳烃,主要有两个竞争反应:
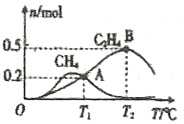
反应I:CO2(g)+4H2(g)  CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应II :2CO2(g)+6H2(g)  C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
在1L恒容密闭容器中充入2molCO2和4molH2测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为______。T1℃时,反应I的平衡常数K=_________(保留三位有效数字)。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)已知反应②中相关化学键键能数据如下:
| 化学键 | H-H | C=O | C≡O | H-O |
| E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2) 一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
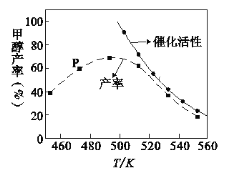
①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态,490K之后,甲醇产率随温度升高而减小的原因除了升高温度使反应①平衡逆向移动以外,还有___________________________________________________________、______________________________________________________________________。
②一定能提高甲醇产率的措施是______。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2+H2,CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。
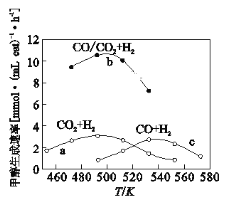
①490K时,根据曲线a、c判断合成甲醇的反应机理是______(填I或II)
Ⅰ.CO2 CO
CO CH3OH
CH3OH
II.CO CO2
CO2 CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,结合反应①、②分析原因___________________________。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i. CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO2(g)+ H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
iii. CH3OH(g) CO(g) +2H2(g) △H3
CO(g) +2H2(g) △H3
回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:
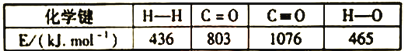
由此计算△H2=__________kJ·mol-1。已知△H3=99kJ·mol-1,则△H1=_________kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。
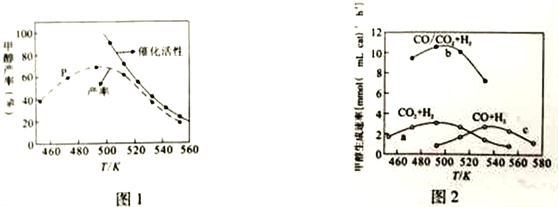
①温度为470K时,图中P点_______ (填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随着温度升高而增大的原因是_______;490K之后,甲醇产率下降的原因是_______。
②一定能提高甲醇产率的措施是______________。
A.增大压强 B,升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
①490K时,根据曲线a、c判断合成甲醇的反应机理是_________ (填“I”或“II")。

②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ⅱ分析原因_________。
CH3OH(g)+ H2O(g) ∆H1=Q kJ·mol-1
CO(g)+H2O(g) ∆H2=+41 kJ·mol-1
CH3OH(g) ∆H3=− 99 kJ·mol-1



CH4(g)+2H2O(g)
C2H4(g)+4H2O(g)