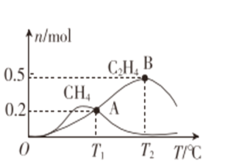
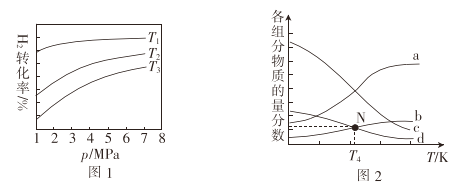
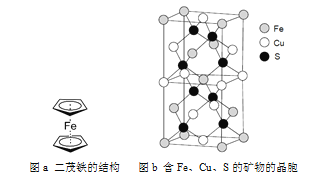
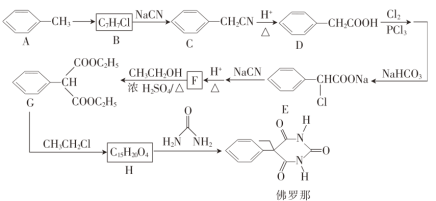
-
2020年的新型冠状病毒中,口罩和医用酒精在防疫工作中起到重要作用,医用口罩由三层无纺布制成,无纺布的主要原料是聚丙烯树脂。下列说法正确的是( )
A.84消毒液、二氧化氯泡腾片可作环境消毒剂
B.聚丙烯树脂属于合成无机高分子材料
C.医用酒精中乙醇的体积分数为 95%
D.抗病毒疫苗冷藏存放的目的是避免蛋白质盐析
难度: 简单查看答案及解析
-
《礼记•内则》中记载“冠带垢,和灰(草木灰)请漱;衣带垢,和灰请浣。”下列说法不正确的是( )
A.文中叙述涉及到水解反应 B.“冠带垢,和灰请漱”有甘油生成
C.文中“灰”主要为NaOH D.文中“垢”成分还有油脂
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2L CO2中含有的共用电子对数为NA
B.2g由D2O与 20Ne组成的混合气体中含有的质子数为NA
C.常温下, 27g铝投入足量的浓硫酸中,生成的SO2分子数为NA
D.100mL 1mol·L−1 FeCl3溶液中所含Fe3+的数目为0.1NA
难度: 中等查看答案及解析
-
下列化学用语表述正确的是( )
A.
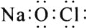 NaClO的电子式
NaClO的电子式B.
和
互为同分异构体
C.比例模型
可以表示二氧化硫分子,也可以表示二氧化碳分子
D.由Na和Cl形成离子键的过程:

难度: 简单查看答案及解析
-
下列颜色变化与氧化还原无关的是( )
A.湿润的红色布条遇到氯气褪色
B.棕黄色的FeCl3饱和溶液滴入沸水中变红褐色
C.紫色酸性KMnO4溶液通入乙烯气体后褪色
D.浅黄色Na2O2固体露置于空气中逐渐变为白色
难度: 简单查看答案及解析
-
下列解释事实的方程式不正确的是( )
A.用K3[Fe(CN)6]检验Fe2+的离子反应方程式:2Fe(CN)63- + 3Fe2+= Fe3[Fe(CN)6]2 ↓
B.含氟牙膏防治龋齿的原理是氟离子会跟羟基磷灰石发生沉淀转化生成氟磷灰石的离子反应方程式:Ca5(PO4)3(OH) +F-
Ca5(PO4)3F +OH -
C.用TiCl4制备TiO2的化学方程式:TiCl4+(x+2)H2O
TiO2·xH2O↓+4HCl
D.已知在重铬酸钾溶液中存在着如下平衡:Cr2O72-+ H2O
H++ 2CrO42-
难度: 中等查看答案及解析
-
合成氨反应
N2(g)+
H2(g)
NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
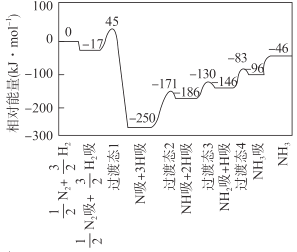
A.该反应的△H = -46 kJ·mol- 1
B.该反应机理中最大活化能为79 kJ·mol- 1
C.升高温度,该反应过渡态的能量会增大
D.该反应达到平衡后增大压强反应正向进行
难度: 中等查看答案及解析
-
下列有机实验的说法正确的是( )
A.用苯萃取溴水中的 Br2,分液时先从分液漏斗下口放出水层,再从上口倒出有机层
B.因为乙烯具有还原性,所以乙烯通入到溴水中能使溴水褪色
C.乙酸乙酯制备实验中,要将导管插入饱和碳酸钠溶液底部以利于充分吸收乙酸和乙醇
D.充满CH4和Cl2的试管倒置在饱和食盐水溶液之上,光照充分反应后,液体会充满试管
难度: 简单查看答案及解析
-
环戊二烯可用于制备二茂铁[Fe(C5H5)2,结构简式为
],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法正确的是( )
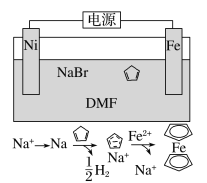
A.该电池工作是,镍连接的是电源的正极
B.可将该电池的DMF惰性有机溶剂更换为NaOH溶液
C.该反应的总反应方程式为Fe+2
+H2↑
D.溶液中的Na+离子不断的向Fe附近移动
难度: 中等查看答案及解析
-
阿巴卡韦(Abacavir)是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体 M(
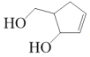 ),下列说法正确的是( )
),下列说法正确的是( )A.与环戊醇互为同系物 B.分子中含有三种官能团
C.能使酸性高锰酸钾溶液和溴水褪色,且原理相同 D.可用碳酸钠溶液鉴别乙酸和 M
难度: 中等查看答案及解析
-
X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2的结构式如图所示。下列说法错误的是
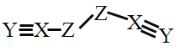
A.化合物WY是良好的耐热冲击材料
B.Y的氧化物对应的水化物可能是弱酸
C.X的氢化物的沸点一定小于Z的
D.化合物(ZXY)2中所有原子均满足8电子稳定结构
难度: 中等查看答案及解析
-
下列有关实验操作、实验操作和实验现象得出的结论均正确的是( )
选项
实验操作
实验现象
结论
A
向5mL浓度均为1mol·L-1的NaOH溶液中先滴入2滴1mol·L-1 MgCl2,再滴入2滴1mol·L-1FeCl3溶液
先有白色沉淀生成,再有红褐色沉淀生成
Ksp[Fe(OH)3]<Ksp[Mg(OH)2]
B
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液
黄色变为浅绿色
维生素C 具有还原性
C
向BaCl2溶液中通入NH3和SO2
无沉淀生成
H2SO3不能与BaCl2反应生成BaSO3和HCl
D
用 pH 试纸分别测量 NaCN 和 NaClO 溶液的 pH
NaClO 的碱性强
Ka(HCN)>Ka(HClO)
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示,下列有关说法不正确的是( )
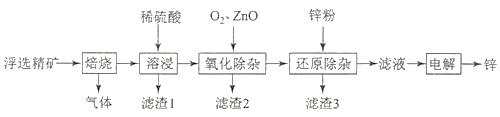
A.滤渣1的成分是SiO2 , 滤渣2的成分是Fe(OH)3
B.焙烧过程中主要反应的化学方程式为2ZnS+3O2
2ZnO+2SO2
C.溶液中的Cd2+可用锌粉除去,反应的离子方程式为Zn+Cd2+=Zn2++Cd
D.若不通入氧气,其后果是无法除去杂质Fe2+
难度: 中等查看答案及解析
-
常温下,用 0.1 mol·L-1 KOH 溶液滴定 10 mL 0.1 mol·L-1 HA(Ka =1.0×10-5)溶液的滴定曲线如图所示。下列说法正确的是( )
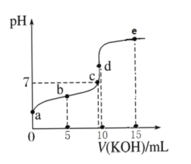
A.a 点溶液的 pH 约为 5
B.水的电离程度:c 点>d 点
C.b 点溶液中粒子浓度大小: c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
D.e 点溶液中:c(K+)=2c(A-)+2c(HA)
难度: 中等查看答案及解析
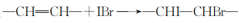 ),立即加塞,摇匀后,将碘量瓶放于黑暗处。
),立即加塞,摇匀后,将碘量瓶放于黑暗处。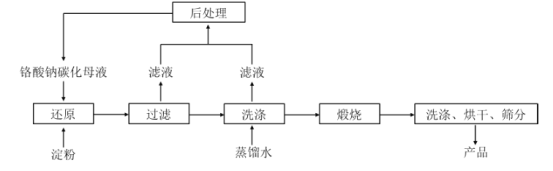

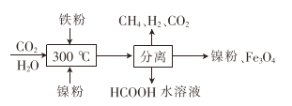
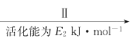 CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)