-
对于下列事实的解释正确的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸具有挥发性
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 氨气可以完成喷泉实验,说明氨气极易溶于水
难度: 中等查看答案及解析
-
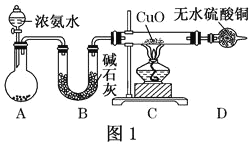
对于硫酸和硝酸的比较中,下列叙述不正确的是
A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
B.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性
C.稀硫酸和稀硝酸都具有氧化性
D.硫酸和硝酸都是重要的化工原料
难度: 简单查看答案及解析
-
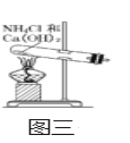
下列关于铵盐的叙述中正确的是
①所有铵盐中,氮元素化合价都是-3价
②所有铵盐都溶于水
③铵态氮肥不宜与碱性物质混合使用
④铵盐都是离子化合物
⑤铵盐都能与碱反应,不能与酸反应
A.①③④ B.②③④
C.①②③④ D.①②③④⑤
难度: 困难查看答案及解析
-
依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是
A. 卤素单质Cl2、Br2、I2的氧化性强弱
B. 气态氢化物NH3、H2O、HF的稳定性
C. 碱金属单质Li、Na、K与水反应的剧烈程度
D. 1 mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少
难度: 简单查看答案及解析
-
几种短周期元素的主要化合价及原子的原子半径数据见下表:
元素代号
L
M
Q
R
T
主要化合价
+2
+3
+6、﹣2
+7、﹣1
﹣2
原子半径/nm
0.160
0.143
0.102
0.099
0.074
据表中信息判断,下列有关叙述中,正确的是( )
A.L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈
B.M与T形成的化合物能和强酸、强碱反应且产物不同
C.Q、T两元素的氢化物热稳定性比较:Q的氢化物大于T的氢化物
D.L与T形成的二元化合物,溶于水生成强碱
难度: 中等查看答案及解析
-
下列反应中属于放热反应的个数是
①酸碱中和反应
②碳和水蒸气高温生成CO和H2的反应
③NH4Cl固体和Ba(OH)2·8H2O固体的反应
④铝热反应
⑤Na与水的反应
⑥铁在Cl2中燃烧
⑦Mg和CO2的反应
A. 2 B. 3 C. 4 D. 5
难度: 简单查看答案及解析
-
下列各组中每种物质都既有离子键又有共价键的一组是( )
A. NaOH H2SO4 (NH4)2SO4 B. MgO Na2SO4 HNO3
C. Na2O2 KOH Na3PO4 D. HCl Al2O3 MgCl2
难度: 简单查看答案及解析
-
下列气体不能用浓硫酸干燥的是
A.O2 B.H2S C.SO2 D.Cl2
难度: 简单查看答案及解析
-
下列说法正确的是( )
①氢键是一种化学键 ②由非金属元素组成的化合物可能是离子化合物 ③离子键只是阳离子、阴离子的相互吸引 ④气体单质分子中一定含有共价键 ⑤由不同种元素组成的多原子分子中,一定只存在极性共价键 ⑥离子化合物中可能有共价键 ⑦共价化合物中可能有离子键
A.②⑥ B.①②③ C.②④⑤ D.②④⑤⑥
难度: 中等查看答案及解析
-
稀土元素是一类有重要用途的资源。铈(Ce)是一种常见的稀土元素,下列有关说法错误的是
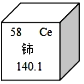
A.铈的原子序数是58 B.铈属于非金属元素
C.铈原子中的质子数是58 D.铈的相对原子质量是140.1
难度: 简单查看答案及解析
-
2016年12月1日国际纯粹与应用化学联合会宣布,将合成的四种新元素命名为113号 (缩写为Nh)、115号(Mc)、117号(Ts)和118号(Og)。下列说法正确的是
A. 113号元素的氧化物为两性氧化物
B. 115号元素位于第六周期第VA族
C. 117号元素的某种原子,核内含176个中子,此原子是
Ts
D. 118号元素的原子最外层有8个电子
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.H2O2的电子式:H+[
]2-H+
B.Cl-的结构示意图:
C.原子核中有10个中子的氧离子:188O2—
D.N2的结构式:N-N
难度: 简单查看答案及解析
-
已知X+结构示意图如下图,则X在元素周期表中的位置是( )
A. 第二周期0族 B. 第四周期ⅠA族
C. 第三周期ⅠA族 D. 第三周期ⅦA族
难度: 简单查看答案及解析
-
短周期元素R、T、Q、W在周期表中的相对位置如图所示,其中Q原子的质子数是其最外层电子数的三倍。下列说法正确的是
A. 原子半径:R>T
B. 氧化物对应水化物的酸性:W>Q
C. 最简单气态氢化物的热稳定性:R>Q
D. Q与W形成的化合物中,各原子的最外层都满足8电子稳定结构
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是
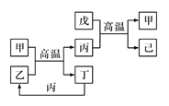
A. W的原子序数是Z的两倍,金属性强于Z
B. W元素在周期表中的位置是第四周期VIII族
C. 丙属于两性氧化物
D. 等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量一定相等
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知:四种原了最外层电子数之和为24。下列说法止确的是

A.元素Ⅹ和元Z的最高正化合价相同
B.单核阴离子半径的大小顺序为:r(W)>r(X)
C.气态简单氢化物的热稳定性顺序为:Y<Z<X<W
D.元素Z的氧化物对应水化物都是强酸
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
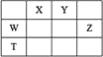
A. X的氢化物的沸点一定低于同主族元素形成的其他氢化物
B. 由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C. W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D. T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和
难度: 中等查看答案及解析
-
为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,
同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( )
A.纯净的E元素的最高价氧化物可用于制造光导纤维
B.
三种元素形成的化合物中一定只含共价键
C.由元素
组成的某种化合物可与
反应生成
D.元素A与
形成的常见化合物中,热稳定性最好的是AD
难度: 中等查看答案及解析