-
主族元素Q、X、Y、Z、W的原子序数依次增大,且均不大于20,X与Y相邻,Y、W的最外层电子数之和等于Z的族序数,Z的最高正价和最低负价代数和为4,化合物Y2Q4可作为火箭推进剂,普遍用在卫星和导弹的姿态控制上。下列说法错误的是
A.X和Z的单质均存在多种同素异形体
B.Q、Y和Z三种元素只能形成共价化合物
C.Q和W形成的化合物的水溶液呈碱性
D.WZXY溶液常用于Fe3+的检验
难度: 简单查看答案及解析
-
唐代《新修本草》中有如下描述:“本来绿色,新出窟未见风者,正如瑠璃。陶及今人谓之石胆,烧之赤色,故名绛矾矣”。“绛矾”指( )
A.硫酸铜晶体 B.硫化汞晶体 C.硫酸亚铁晶体 D.硫酸锌晶体
难度: 简单查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
向发黄的浓硝酸中通入O2
黄色褪去
浓硝酸中混有Fe3+
B
向无色溶液中滴加FeCl3溶液和CCl4,振荡、静置
下层显紫红色
原溶液中含有I-
C
向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液
紫红色褪去
乙醇发生了消去反应
D
向浓度均为0.1mol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)<Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法错误的是( )
A.12g石墨中含有σ键的物质的量为1.5mol
B.硫离子电子共有18种运动状态,且其2p与3p轨道形状和能量相等
C.电负性:C<N<O
D.I3+离子的几何构型是V型
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LH2S溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.向100mL0.5mol·L-1Fe(NO3)3溶液中通入足量SO2气体,转移电子数为0.05NA
难度: 中等查看答案及解析
-
明矾[KAl(SO4)2·12H2O]是一种重要的化学试剂。下列说法正确的是( )
A.含明矾的药物不宜与胃药奥美拉唑碳酸氢钠胶囊同时服用
B.0.1mol·L-1明矾溶液完全水解生成Al(OH)3胶粒数小于6.02×1022
C.向含0.1mol明矾的溶液中滴入Ba(OH)2溶液,当生成沉淀的质量最大时,SO42-和Al3+全部转化为BaSO4和Al(OH)3沉淀
D.室温下,0.1mol·L-1明矾溶液中水电离出c(H+)小于10-7mol·L-1
难度: 中等查看答案及解析
-
下列有关说法正确的是
①二氧化硅可与NaOH溶液反应,因此可用NaOH溶液雕刻玻璃;
② 明矾溶于水可水解生成Al(OH)3胶体,因此可以用明矾对自来水进行杀菌消毒;
③ 可用蒸馏法、电渗析法、离子交换法等对海水进行淡化;
④ 从海带中提取碘只需用到蒸馏水、H2O2溶液和四氯化碳三种试剂;
⑤地沟油可用来制肥皂、提取甘油或者生产生物柴油;
⑥石英玻璃、Na2O·CaO·6SiO2、淀粉、氨水的物质类别依次为纯净物、氧化物、混合物、弱电解质。
A. ③⑤⑥ B. ①④⑤ C. 除②外都正确 D. ③⑤
难度: 中等查看答案及解析
-
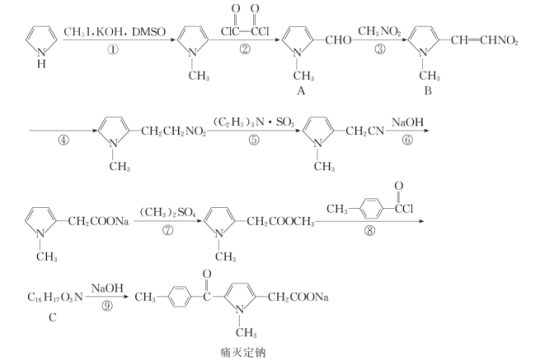
司替戊醇(d)用于治疗两岁及以上Dravet综合征相关癫痫发作患者,其合成路线如图所示。下列有关判断正确的是( )

A.b的一氯代物有4种
B.c的分子式为C14H14O3
C.1mold最多能与4molH2发生加成反应
D.d中所有碳原子可能处于同一平面
难度: 中等查看答案及解析
-
某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是

A. X可以是稀硫酸或稀硝酸或稀盐酸
B. 实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C. 反应一段时间后可在烧瓶中观察到白色沉淀
D. 反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
难度: 中等查看答案及解析
-
乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一,以乙烯为原料合成的部分产品如图所示。下列有关说法正确的是( )
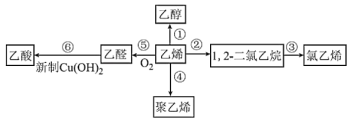
A.氧化反应有①⑤⑥,加成反应有②③
B.氯乙烯、聚乙烯都能使酸性KMnO4溶液褪色
C.在加热条件下,反应⑥的现象为产生砖红色沉淀
D.可用乙醇萃取Br2的CCl4溶液中的Br2
难度: 中等查看答案及解析
-
固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、K[Al(OH)4]、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:

根据上述实验,以下说法正确的是( )
A.气体A一定只是NO
B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液甲中含有K2SO3
C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3
D.溶液甲中一定含有K2SiO3,可能含有K[Al(OH)4]、MgCl2
难度: 困难查看答案及解析
-
对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5
NO2+NO3 ΔH1 快速平衡
第二步 NO2+NO3→NO+NO2+O2 ΔH2 慢反应
第三步 NO+NO3→2NO2 ΔH3 快反应
下列说法正确的是( )
A.使用催化剂可以改变第一步中NO2平衡产量
B.第二步NO2和NO3的碰撞都是有效的
C.反应2N2O5(g)→4NO2(g)+O2(g)的ΔH=2ΔH1+ΔH2+ΔH3
D.第二步反应的活化能小于第三步反应的活化能
难度: 中等查看答案及解析
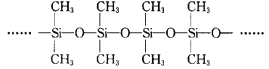
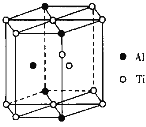
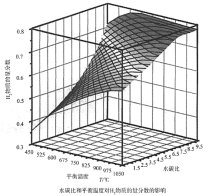
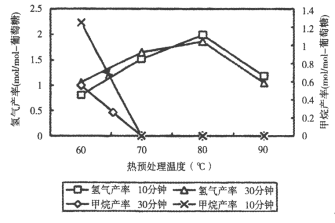
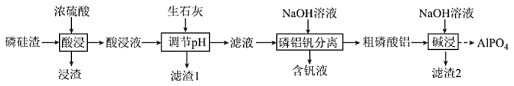
 CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题: