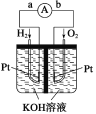
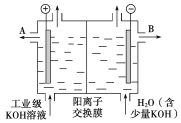
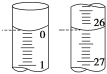
-
下列离子方程式中书写正确的是( )
A.铁和稀硫酸反应: 2Fe+6H+===2Fe3++3H2↑
B.碳酸钙和稀盐酸反应: CaCO3+2H+===Ca2++CO2↑+H2O
C.铜和硝酸银溶液反应: Cu+Ag+===Cu2++Ag
D.硫酸镁溶液与氢氧化钡溶液反应: Mg2++2OH-===Mg(OH)2↓
难度: 中等查看答案及解析
-
下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀
难度: 简单查看答案及解析
-
某同学在实验报告中记录了下列数据,其中正确的是
A.用托盘天平称取5.85 g食盐
B.用10 mL量筒量取7.35 mL盐酸
C.用pH计测出某溶液pH为3.52
D.从碱式滴定管放出酸性KMnO4溶液15.60 mL
难度: 简单查看答案及解析
-
化学与生活、社会发展息息相关。下列说法错误的是( )
A.燃料电池的能量转化率可达100%
B.用可溶性的铝盐或铁盐处理水中的悬浮物
C.金属焊接时,可用NH4Cl溶液作除锈剂
D.食品中用木糖醇作甜味剂,可降低糖尿病的发病率
难度: 简单查看答案及解析
-
下列反应中,属于氧化还原反应的是( )
A.2H2O2
2H2O+O2↑
B.2NO2
N2O4
C.FeO+2HCl=FeCl2+H2O
D.FeCl2+2NaOH=Fe(OH)2↓+2NaCl
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ•mol-1
B.反应物和生成物所具有的总能量决定了反应是放热还是吸热
C.任何放热反应在常温下一定能发生
D.化学反应中的能量变化都表现为热量变化
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1molCO2中含有原子数NA
B.1L1mol/L的碳酸钠溶液中,所含CO32-数为NA
C.标准状况下,11.2L水所含分子数为0.5NA
D.在反应中,1molFe和足量稀硝酸反应失去的电子数为3NA
难度: 中等查看答案及解析
-
下列各组离子在无色溶液中能大量共存的是
A.H+、Cl-、SO42-、K+ B.K+、H+、Na+、HCO3-
C.Cu2+、K+、SO42-、Cl- D.Ag+、NO3-、Cl-、K+
难度: 中等查看答案及解析
-
下列反应中,水作氧化剂的是( )
A.Na2O2与水 B.铁粉与水蒸气 C.NO2与水 D.氟气与水
难度: 简单查看答案及解析
-
有如下三个热化学方程式:
H2(g)+
O2(g)=H2O(g) ΔH=akJ·mol-1
H2(g)+
O2(g)=H2O(l) ΔH=bkJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=ckJ·mol-1
关于它们的下列表述正确的是( )
A.它们都是吸热反应 B.a=b
C.2b=c D.a、b和c均为正值
难度: 简单查看答案及解析
-
白磷会对人体造成严重的烧伤,白磷(P4)分子结构为
。下列说法不正确的是
A.白磷着火点低,在空气中可自燃
B.白磷、红磷互为同素异形体
C.31 g白磷中,含P—P键1.5 mol
D.已知P4(白磷,s)+3O2(g)=2P2O3(s) ΔH=-Q kJ·mol-1,则白磷的燃烧热为Q kJ·mol-1
难度: 中等查看答案及解析
-
在恒温、体积为2L的密闭容器中进行反应:2A(g)
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
A.v(A)=0.06mol·L-1·s-1 B.v(B)=0.045mol·L-1·s-1
C.v(C)=0.03mol·L-1·s-1 D.v(C)=0.06mol·L-1·s-1
难度: 简单查看答案及解析
-
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
难度: 简单查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g),下列措施能使反应中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在纯水中加入盐一定促进水的电离
B.同温时,等浓度的NaHCO3和Na2CO3溶液,NaHCO3溶液的pH大
C.加热CH3COONa溶液,溶液中
的值将变大
D.0.1mol·L-1HA弱酸溶液与0.05mol·L-1NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-)
难度: 中等查看答案及解析
-
下列电离或水解方程式中,正确的是( )
A.NH4++H2O
NH3·H2O+H+
B.NaHCO3=Na++H++CO32-
C.H2S
2H++S2-
D.CH3COOH+H2O=CH3COO-+H3O+
难度: 简单查看答案及解析
-
常温下,在1L0.1mol·L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
难度: 简单查看答案及解析
-
在一定条件下,Na2CO3溶液存在水解平衡:CO32ˉ+H2O
HCO3ˉ+OHˉ。下列说法正确的是
A.稀释溶液,上述可逆反应平衡常数不变 B.通入CO2,溶液pH增大
C.加入NaOH固体,平衡向正反应方向移动 D.升高温度,
不变
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.洗涤油污常用热的纯碱溶液
C.用加热的方法可以除去KCl溶液中的Fe3+
D.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
难度: 中等查看答案及解析
-
用石墨作电极,电解下列物质的溶液,其实质不是电解水的是( )
A.NaNO3 B.NaOH C.Na2SO4 D.BaCl2
难度: 简单查看答案及解析
-
近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
A.C2H5OH在电池的负极上参加反应
B.正极反应式为4H++O2+4e-=2H2O
C.在外电路中电子由负极沿导线流向正极
D.1mol乙醇被氧化转移6mol电子
难度: 中等查看答案及解析