-
化学与生活密切相关。 下列叙述错误的是
A.疫苗因未冷藏储运而失效,与蛋白质变性有关
B.天然气既是高效清洁的化石燃料,又是重要的化工原料
C.“中国天眼”的镜片材料为SiC,属于新型有机非金属材料
D.港珠澳大桥水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
有机物
是制备镇痛剂的中间体。 下列关于该有机物的说法正确的是
A.易溶于水及苯 B.所有原子可处同一平面
C.能发生氧化反应和加成反应 D.一氯代物有5种(不考虑立体异构)
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大。其中W的气态氢化物常用作制冷剂;X原子的核外电子层数与最外层电子数相等;Y主族序数大于W。 下列说法正确的是
A.原子半径:W>X B.最简单氢化物的热稳定性:Y>Z
C.工业上通过电解熔融XZ3冶炼X单质 D.WO2、YO2、ZO2均为共价化合物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.4.0g由CO2和SO2组成的混合物中含有的质子数为2NA
B.1L0.5mol/LpH=7的CH3COONH4溶液中NH4+数目为0.5NA
C.常温下,0.1mol环氧乙烷(
)中含有的共价键数目为0.3NA
D.22.4LCO2与足量Na2O2充分反应,转移的电子数目为NA
难度: 中等查看答案及解析
-
下列实验能达到目的的是
选项
目的
实验
A
验证某气体表现还原性
将某气体通入溴水中,溴水褪色
B
制备少量二氧化硫气体
向饱和亚硫酸溶液中滴加浓硫酸
C
制备硅酸胶体
向硅酸钠水溶液中逐滴滴加浓盐酸至溶液呈强酸性
D
配制0.2mol/L的CH3COOH溶液
准确量取100mL2mol/L的CH3COOH溶液,加入烧杯中稀释后迅速转移至1000mL容量瓶中,然后加蒸馏水定容
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
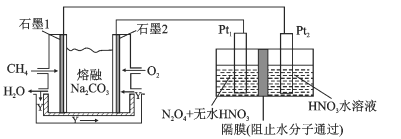
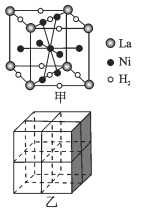
科学家利用电解NaB(OH)4溶液制备H3BO3的工作原理如下图。 下列说法中正确的是
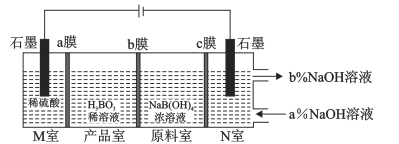
A.b膜为阳离子交换膜
B.N室中,进口和出口NaOH溶液的浓度:a%<b%
C.电子从左边石墨电极流出,先后经过a、b、c膜流向右边石墨电极
D.理论上每生成1molH3BO3,两极室共生成33.6L气体(标准状况)
难度: 中等查看答案及解析
-
t℃时,向20.00mL0.1mol/L二元弱酸H2X溶液中滴入0.1mol/LNaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-lgc 水(OH-)]与所加NaOH溶液体积的关系如图所示。下列说法中不正确的是
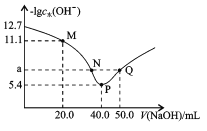
A.M点溶液中:c(Na+)>c(HX-)>c(H2X)
B.P点溶液中: c(OH-)-c(H+)=c(HX-)+2c(H2X)
C.溶液中
D.水的电离程度:P>N=Q>M,且a=7
难度: 困难查看答案及解析
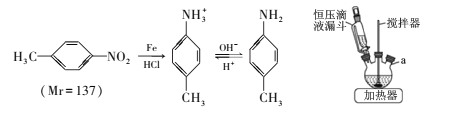
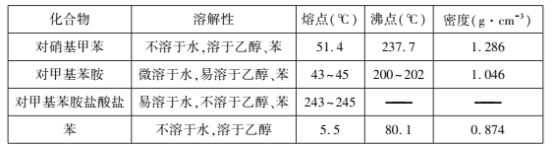
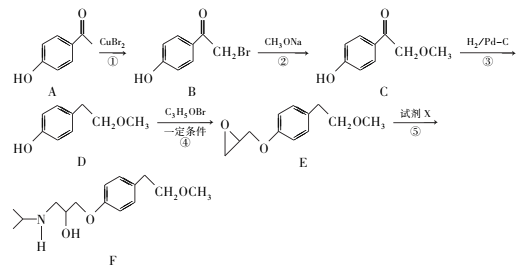
 和CH3OH、CH3ONa为原料制备
和CH3OH、CH3ONa为原料制备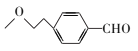 的合成路线流程图(无机试剂任选)____。
的合成路线流程图(无机试剂任选)____。