-
建国70周年阅兵式上,飞机拉烟原理是吊舱中的彩烟剂被加压N2吹出,送入高温尾气中,尾气中的蒸汽遇冷凝结成雾,形成“彩烟”。下列有关说法正确的是( )
A.彩烟是一种纯净物
B.蒸汽凝结为雾发生了化学变化
C.蒸汽遇冷形成的雾是一种分散系
D.拉烟原理与焰色试验的原理相同
难度: 简单查看答案及解析
-
下列元素属于短周期主族元素的是( )
A.碘 B.铁 C.P D.K
难度: 简单查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是( )
A.蔗糖溶液 B.硫酸铜溶液 C.氢氧化铁胶体 D.饱和食盐水
难度: 简单查看答案及解析
-
下列各项是关于玻璃棒在若干实验中的用途及操作,其中不正确的是( )
A.溶解物质时搅拌
B.蘸取少量溶液做焰色试验
C.过滤时向漏斗中转移液体
D.配制一定物质的量浓度的溶液时引流
难度: 简单查看答案及解析
-
用NaOH固体配制250mL1.00mol/LNaOH溶液时,不必用到的仪器是( )
A.试管 B.烧杯 C.胶头滴管 D.容量瓶
难度: 简单查看答案及解析
-
已知CCl4为非电解质,HCl为电解质,则下列物质中一定含有Cl-的是( )
A.HCl气体 B.液态CCl4 C.KClO3溶液 D.KCl溶液
难度: 简单查看答案及解析
-
图表资料可以为我们提供很多信息。下面是某学生对图表资料的使用,其中不正确的是( )
A.根据某原子的结构示意图直接判断该原子的原子核内的中子数
B.根据金属活动性顺序表,可以判断溶液中的某些置换反应能否发生
C.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行
D.根据元素周期表,可以寻找某些半导体材料
难度: 简单查看答案及解析
-
下列关于化学键的说法中,不正确的是( )
A.化学反应过程包含反应物中化学键断裂和生成物中化学键形成
B.氯化钠固体溶解于水的过程中有离子键被破坏
C.是相邻原子或离子间的强烈的相互作用
D.非极性键不属于化学键
难度: 简单查看答案及解析
-
在元素周期表中,元素性质随原子序数的递增呈现周期性变化的本质原因是( )
A.中子数逐渐增多
B.相对原子质量逐渐增大
C.核外电子排布呈现周期性变化
D.元素化合价呈现周期性变化
难度: 简单查看答案及解析
-
某些建筑材料中含有放射性元素
Rn(氡),会对人体产生一定危害。该原子的质子数与中子数之和是( )
A.50 B.86 C.136 D.222
难度: 简单查看答案及解析
-
科学家制得一种新型分子O4。关于O4和O2的说法不正确的是( )
A.互为同素异形体
B.等质量的O4和O2所含原子数相同
C.都含有共价键
D.它们的摩尔质量相同
难度: 简单查看答案及解析
-
如图展示了近代化学发展的几个重要里程碑。下列说法正确的是( )

A.1661年波义耳提出了元素的概念并发现了同位素
B.1774年拉瓦锡提出燃烧的氧化学说并揭示了氧化还原反应的本质
C.1803年道尔顿提出原子学说并揭示了原子构成的奥秘
D.1869年门捷列夫发现了元素周期律并制成了第一张元素周期表
难度: 简单查看答案及解析
-
下列物质的保存方法,与其化学性质无关的是( )
A.金属钠保存在煤油中
B.浓盐酸需密闭保存
C.新制氯水密闭存放于棕色瓶中
D.过氧化钠需保持干燥密闭保存
难度: 简单查看答案及解析
-
下列各项表达正确的是( )
A.用电子式表示CaCl2的形成过程:
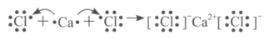
B.硫酸与氢氧化钡溶液反应的离子方程式:Ba2++SO42-=BaSO4↓
C.金属钠在空气中受热燃烧:4Na+O2=2Na2O
D.铁丝与稀硫酸反应的离子方程式:2Fe+6H+=2Fe3++3H2↑
难度: 简单查看答案及解析
-
下列有关物质性质的比较,可以用元素周期律加以解释的是( )
A.酸性:H2SO4>H3PO4
B.溶解度(25℃):BaCl2>BaSO4
C.沸点:H2O>NH3
D.热稳定性:Na2CO3>NaHCO3
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.1molCl2含有的分子数为6.02×1023
B.标准状况下,22.4LH2的质量是1g
C.1molN2分子的质量是
g
D.完全中和100mL0.1mol/L的盐酸,至少需要0.2mol/L的NaOH溶液200mL
难度: 简单查看答案及解析
-
下列关于100mL0.1mol/LNa2SO4溶液的说法中,正确的是( )
A.分散质粒子直径大于1nm
B.所含硫酸钠的物质的量是0.1mol
C.与50mL0.2mol/LNaCl溶液中所含c(Na+)相同
D.取出50mL溶液后,剩余溶液中溶质的物质的量浓度为0.05mol/L
难度: 简单查看答案及解析
-
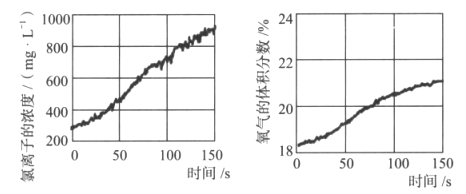
利用下列物质间的反应,能够说明“反应条件(如温度、浓度、用量等)不同得到产物不同”的观点的是( )
A.金属钠与水 B.铁粉与盐酸
C.氢气与氯气 D.二氧化碳和澄清石灰水
难度: 简单查看答案及解析
-
下列物质或离子检验的方法,正确的是( )
A.某物质的焰色呈黄色,则该物质中一定不含有钾元素
B.某气体可使湿润的淀粉KI溶液变蓝,则该气体一定是Cl2
C.加入AgNO3溶液,产生白色沉淀,则原溶液中一定存在Cl-
D.某溶液中滴入KSCN溶液不变红,再滴入氯水后溶液变红,则原溶液中一定含有Fe2+
难度: 简单查看答案及解析
-
下列除杂试剂的选择或除杂操作不正确的是( )
选项
物质(括号内为杂质)
除杂试剂或物质
除杂操作
A
Fe(Cu)固体
磁铁
吸引后弃去剩余固体
B
Na2CO3(NaHCO3)溶液
CO2
通入过量CO2
C
FeCl2(FeCl3)溶液
Fe
加入过量Fe粉,充分反应后过滤
D
CO2(HCl)气体
饱和NaHCO3溶液、浓H2SO4
依次充分洗气
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在短周期主族元素X、Y、Z中,X与Y两元素的原子核外的电子层数相同,X的原子半径大于Y的原子半径,X的阳离子与Z的阳离子具有相同的电子层结构,Z的简单离子半径大于X的简单离子半径。则关于X、Y、Z的叙述正确的是( )
A.三种元素的原子序数最大的是Z
B.Z一定是非金属元素
C.三种元素不一定是同周期元素
D.三种元素可能都是金属元素
难度: 简单查看答案及解析
-
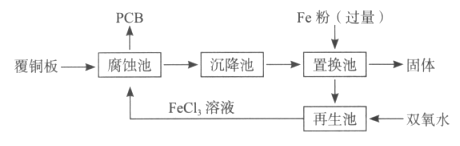
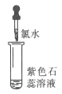
下图是实验室制备K2FeO4的实验装置图,其中甲为制氯气的装置。(资料:K2FeO4为紫色固体,微溶于KOH,具有强氧化性)
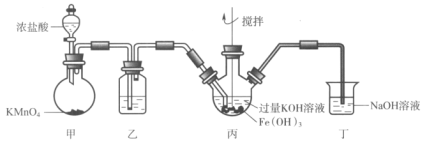
下列说法不正确的是( )
A.乙中所用试剂为饱和食盐水
B.丙和丁中均会发生反应:Cl2+2OH-=Cl-+ClO-+H2O
C.丙中产生紫色固体,说明碱性条件下,Cl2氧化性强于K2FeO4
D.若取反应后丙中紫色溶液,加入稀硫酸产生Cl2,则证明了K2FeO4具有氧化性
难度: 中等查看答案及解析