-
物质的性质决定其用途。下列说法正确的是
A.二氧化氯具有强氧化性,可用来漂白织物
B.氯化铝是强电解质,可电解其水溶液获得金属铝
C.石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
难度: 中等查看答案及解析
-
W、X、Y、Z是同周期主族元素,Y 的最外层电子数是 X 次外层电子数的 3倍,四种元素与锂组成的盐是一种新型电池的电解质(结构如图,箭头指向表示共用电子对由 W 提供)。下列说法不正确的是( )
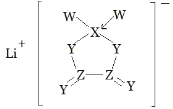
A.W的非金属性比Y的强
B.原子半径Z比X大
C.该物质中含离子键和共价键
D.该物质中Ⅹ原子满足8电子稳定结构
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.6.0gSiO2晶体中含有共价键的数目为 0.2NA
B.标准状况下,22.4L甲醇中含有的 C-H 键数目为 0.3NA
C.室温下,53.5gNH4Cl晶体溶于氨水中,所得溶液 pH=7,NH
的数目为NA
D.用铅蓄电池电解氯化钠溶液,得到22.4L H2,铅蓄电池中消耗氢离子数为4NA
难度: 简单查看答案及解析
-
螺环化合物
可用于制造生物检测机器人,下列有关该化合物的说法错误的是
A.分子式为C5H8O
B.是环氧乙烷
的同系物
C.一氯代物有2种(不考虑空间异构)
D.所有碳原子不处于同一平面
难度: 中等查看答案及解析
-
下图所示实验装置,能达到对应实验目的或现象描述正确的是( )
A.
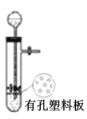 所示装置用于 Cu 和浓 H2SO4 制取少量的 SO2 气体
所示装置用于 Cu 和浓 H2SO4 制取少量的 SO2 气体B.
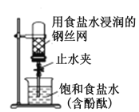 打开图中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
打开图中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中C.
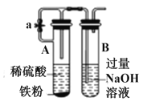 利用图所示装置制取 Fe(OH)2
利用图所示装置制取 Fe(OH)2D.
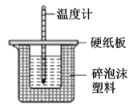 利用图测定中和反应反应热
利用图测定中和反应反应热难度: 中等查看答案及解析
-
2019年 11月《Science》杂志报道了王浩天教授团队发明的制取 H2O2 的绿色方法,原理如图所示(已知:H2O2
H++HO2-,Ka=2.4×10-12。下列说错误的是( )
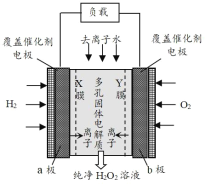
A.X膜为阳离子交换膜
B.每生成 1mol H2O2外电路通过4mol e-
C.催化剂可加快单位时间内反应中电子的转移数目
D.b极上的电极反应为:O2+ H2O + 2e- = HO2 + OH-
难度: 中等查看答案及解析
-
H2CO3 和 H2C2O4 都是二元弱酸,常温下,不同 pH环境下它们不同形态的粒子的组成百分率如图所示:
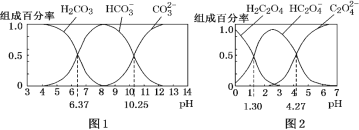
下列说法正确的是( )
A.在 pH为6.37及10.25时,溶液均存在 c(H2CO3)=c(HCO3-)=c(CO32-)
B.反应 CO32-+H2O
HCO3-+OH- 的平衡常数为10-7.23
C.0.1 mol·L-1NaHC2O4 溶液中 c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.往Na2CO3溶液中加入少量草酸溶液,发生反应:2CO32−+H2C2O4=2HCO3−+C2O42−
难度: 中等查看答案及解析

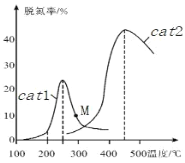
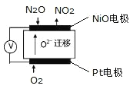
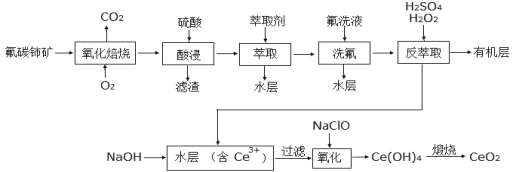
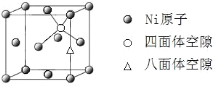
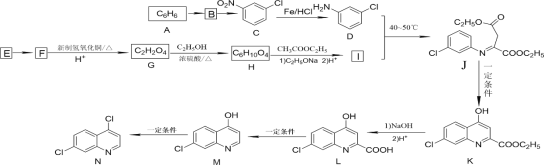

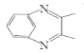 的路线_____ (无机试剂任选)
的路线_____ (无机试剂任选)