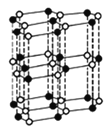
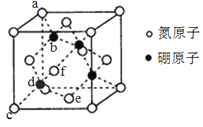
-
化学与生产、生活有关,下列说法正确的是
A.将淀粉在稀硫酸中最后水解产物与银氨溶液混合,水浴加热后可出现光亮的银镜
B.尼龙绳、宣纸、棉衬衣这些生活用品中都主要由合成纤维制造
C.核磁共振谱、红外光谱和质谱法都可以分析有机物的结构
D.蔗糖和麦芽糖互为同分异构体,两者水解产物可与新制的Cu(OH)2悬浊液反应
难度: 简单查看答案及解析
-
下列说法正确的是
A.“量子化”就是不连续的意思,微观粒子运动均有此特点
B.英国科学家道尔顿首先发现了电子
C.焰色反应与电子跃迁有关,属于化学变化
D.基态氢原子转变成激发态氢原子时释放能量
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.-OH的电子式:
B.钙原子的M层电子轨道表示式:
C.氯离子的核外电子排布式:1s22s22p63s23p6
D.K+的离子结构示意图:
难度: 简单查看答案及解析
-
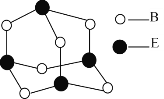
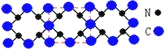
H、C、N、O、V(钒)五种元素形成的某分子结构如图所示,下列说法错误是
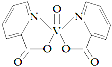
A.N原子核外存在3种不同能量的电子
B.基态V原子的价电子轨道表示式为
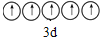
C.基态O原子,电子占据的最高能级符号为2p
D.基态C、N两种原子中,核外存在相同对数自旋方向相反的电子
难度: 中等查看答案及解析
-
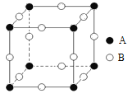
下列关于晶体的说法,正确的是
A.在晶体中只要有阳离子就一定有阴离子
B.金刚石、SiC、HF、HBr晶体的熔点依次降低
C.晶体中分子间作用力越大,分子越稳定
D.Al固体为金属晶体,AlCl3固体为离子晶体
难度: 简单查看答案及解析
-
短周期元素R的p轨道上有3个未成对电子,则该元素的氧化物对应的水化物的化学式不可能是
A.H3RO4 B.HRO2 C.H3RO3 D.H2RO4
难度: 简单查看答案及解析
-
光气(COCl2)又称碳酰氯,下列关于光气的叙述中正确的是
A.COCl2中含有2个σ键和1个π键
B.COCl2中C原子杂化轨道类型为sp2
C.COCl2为含极性键和非极性键的极性分子
D.COCl2分子的空间构型为三角锥形
难度: 中等查看答案及解析
-
下列推论错误的是
A.NaCl为离子晶体,可推测CsCl也为离子晶体
B.CO2晶体是分子晶体,可推测CS2晶体也是分子晶体
C.NH4+为正四面体结构,可推测PH4+也为正四面体结构
D.NCl3中N原子是sp3杂化,可推测BCl3中B原子也是sp3杂化
难度: 中等查看答案及解析
-
有关乙炔、苯及二氧化碳的说法错误的是
A.苯中6个碳原子中杂化轨道中的一个以“肩并肩”形式形成一个大π键
B.二氧化碳和乙炔中碳原子均采用sp1杂化,苯中碳原子采用sp2杂化
C.乙炔中两个碳原子间存在1个σ键和2个π键
D.乙炔、苯、二氧化碳均为非极性分子
难度: 中等查看答案及解析
-
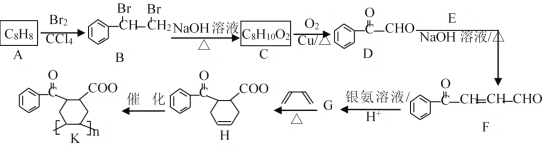
伞形酮可用作酸碱指示剂,可由雷琐苯乙酮和苹果酸在一定条件下反应制得。下列说法中错误的是

A.1mol伞形酮与足量NaOH溶液反应,最多可消耗3mol NaOH
B.1 mol雷琐苯乙酮最多可与4 mol H2发生加成反应
C.苹果酸发生缩聚反应最多可生成2种高分子化合物
D.雷琐苯乙酮在一定条件下可发生氧化、取代、缩聚等反应
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A.
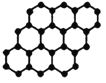 24g石墨烯中含有C-C键的个数为3NA
24g石墨烯中含有C-C键的个数为3NAB.
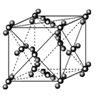 88g干冰中含有NA个晶胞结构单元
88g干冰中含有NA个晶胞结构单元C.
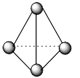 62 g P4含有P-P键的个数为6NA
62 g P4含有P-P键的个数为6NAD.
 60gSiO2中含有Si-O键的个数为2NA
60gSiO2中含有Si-O键的个数为2NA难度: 中等查看答案及解析
-
下列说法均正确的组合为
①s-s σ键与s-p σ键的电子云形状相同
②第四周期的元素基态原子中,4s能级只有1个电子的元素共有3种
③钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显0价
④中心原子采取sp3杂化的分子,其立体构型一定是正四面体
⑤2-丁醇中存在手性碳原子
⑥相对分子质量:CH3CH2OH>CH3CHO,所以沸点:CH3CH2OH>CH3CHO
A.②③⑤ B.③⑤ C.①②④ D.④⑥
难度: 中等查看答案及解析
-
下列有关物质性质说法中,正确的是
A.熔点:Li<Na<K<Rb
B.热稳定性:HF>HI>HBr>HCl
C.具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是①
D.某元素气态基态原子的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+,其最高正价为+5价
难度: 中等查看答案及解析
-
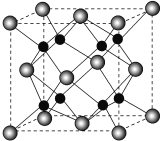
已知C3N4晶体的硬度与金刚石相差不大,且原子间均以单键结合,下列关于C3N4的说法错误的是
A.该晶体中碳原子和氮原子的最外层都满足8电子稳定结构
B.C3N4晶体中C-N键的键长比金刚石的C-C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,每个N原子连接3个C原子
D.该晶体与金刚石相似,都是原子间以共价键形成的空间网状结构
难度: 中等查看答案及解析
-
在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.2Na2O+2H2O=4NaOH
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.NH4Cl+NaOH
NaCl+NH3↑+H2O
难度: 简单查看答案及解析
-
下列有关说法正确是
A.
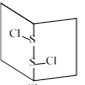 表明S2Cl2为非极性分子
表明S2Cl2为非极性分子B.
表明1个碳酸亚乙烯分子中含6个σ键
C.
表明每个P4S3分子中含孤电子对的数目为6个
D.
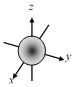 表明1s轨道呈球形,有无数对称轴
表明1s轨道呈球形,有无数对称轴难度: 中等查看答案及解析
-
下表为元素周期表前四周期的一部分,下列有关X、Y、Z、R、W五种元素的叙述中,错误的是
X
Y
Z
R
W
A.常压下五种元素的单质中,Y的沸点最高
B.元素电负性:X>Z>Y
C.基态原子中未成对电子数最多的是R
D.元素最高价氧化物对应的水化物酸性:W>Z>Y
难度: 中等查看答案及解析
-
下列关系比较及解析有错误的是
选项
关系
解析
A
Mg原子的第一电离能大于Al原子
Mg原子3s能级全充满
B
原子半径:Cl<S
Cl、S原子电子层数相同,但Cl原子核电荷数较S多,对核外电子吸引能力比S强
C
沸点:对羟基苯甲醛>邻羟基苯甲醛
对羟基苯甲醛存在分子间氢键,邻羟基苯甲醛存在分子内氢键,分子间氢键对它们沸点的影响大于分子内氢键对它们沸点的影响
D
配位体个数:[Co(NH3)6]Cl2>[Co(NH3)5Cl]Cl2
[Co(NH3)6]Cl2和[Co(NH3)5Cl]Cl2 分别有6个和5个NH3,所以配位体个数:[Co(NH3)6]Cl2>[Co(NH3)5Cl]Cl2
A.A B.B C.C D.D
难度: 中等查看答案及解析
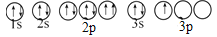
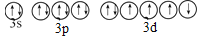
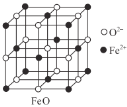 乙.
乙.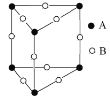 丙.
丙.