-
可逆反应:2NO2(g) ⇌2NO(g)+O2(g),在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦
C.①③④⑤ D.全部
难度: 中等查看答案及解析
-
有关H、D、T、HD、H2、D+、H-这七种微粒的说法正确的是
A.互为同位素 B.是七种氢元素
C.HD和H2均是单质 D.电子数相同
难度: 中等查看答案及解析
-
若把周期表原先的主、副族号取消,由左到右按原顺序编为18纵行。如碱金属为第1纵行,稀有气体为第18纵行,按这个规定,下列说法不正确的是( )
A.计算机芯片的组成元素位于第14纵行
B.第10纵行元素全部是金属元素
C.第18纵行元素单质全部是气体
D.只有第2纵行元素的原子最外层有2个电子
难度: 简单查看答案及解析
-
100mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
难度: 中等查看答案及解析
-
下列各组顺序的排列不正确的是
A.熔点:金刚石>干冰 B.离子半径:O2-> Na+
C.碱性:KOH > Al(OH)3 D.稳定性:SiH4> H2S
难度: 中等查看答案及解析
-
下列各项中表达正确的是( )
A. F—的结构示意图:
B. CO2的分子模型示意图:
C. NaCl的电子式:
D. N2的结构式: :N≡N:
难度: 中等查看答案及解析
-
下列叙述正确的是
A.离子晶体中,只存在离子健,不可能存在其它化学键
B.可燃冰中甲烷分子与水分子之间存在氢键
C.Na2O2、NaHSO4晶体中的阴、阳离子个数比均为1 2
D.晶体熔点:金刚石>食盐>冰>干冰
难度: 中等查看答案及解析
-
我国著名化学家张青莲教授测定的锑元素的相对原子质量为127.760,被国际原子量委员会采用为国际新标准。已知锑有两种以上天然同位素,则127.760是( )
A. 按照锑的各种天然同位素的质量数与这些同位素所占的原子百分比计算出来的平均值
B. 按照锑的各种天然同位素的相对原子质量与这些同位素所占的原子百分比计算出来的平均值
C. 一个锑原子的质量与12C原子质量的1/12的比值
D. 锑元素的质量与12C原子质量的1/12的比值
难度: 中等查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A. 离子的还原性:Y2->Z- B. 氢化物的稳定性:H2Y>HZ
C. 质子数:c>b D. 原子半径:X<W
难度: 简单查看答案及解析
-
在下列变化过程中,既有离子键被破坏又有共价键被破坏的是 ( )
A.金刚石熔化 B.NaOH溶于水
C.将HCl通入水中 D.NaHSO4溶于水
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小, Y的次外层电子数是最外层的
,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
A. 原子半径:rW>rZ>rY
B. 化合物ZX中各原子均满足8电子稳定结构
C. 由X、Y、Z、W组成的化合物的水溶液可能显酸性
D. 简单气态氢化物稳定性:W>Y
难度: 中等查看答案及解析
-
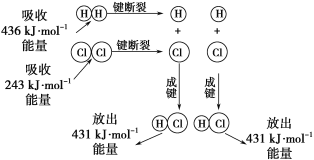
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
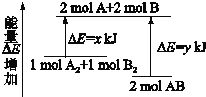
A.该反应是吸热反应
B.断裂1molA-A键和1molB-B键能放出xkJ的能量
C.断裂2molA-B键需要吸收ykJ的能量
D.2molAB的总能量高于1moA2和1molB2的总能量
难度: 中等查看答案及解析
-
下列叙述正确的是( )
①两种原子构成的分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失去电子的原子,易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
A.只有②⑦ B.只有①⑦ C.只有⑦ D.只有①⑤⑦
难度: 简单查看答案及解析
-
元素周期表是一座开放的“元素大厦”,元素大厦尚未充满。若发现119号元素,请您在元素大厦中安排好它的“房间”
A. 第八周期第ⅠA族 B. 第七周期第0族
C. 第七周期第ⅦA族 D. 第六周期ⅡA族
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. 对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
B. 任何放热反应在常温条件下一定能发生反应
C. 形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应
D. 等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
难度: 中等查看答案及解析
-
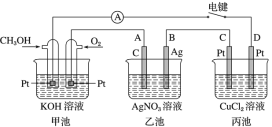
在图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )

A. 碳棒上有气体放出,溶液的pH增大
B. 导线中有电子流动,电子从a极流到b极
C. a是正极,b是负极
D. a极上发生了氧化反应
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用 98%浓硫酸可加快产生氢气的速率
B.100mL2mol/L 的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2 的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的 NO 和 CO 可缓慢反应生成 N2 和 CO2,减小压强速率减慢
难度: 简单查看答案及解析
-
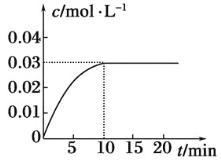
一定温度下,在容积为1L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列表述中正确的是( )
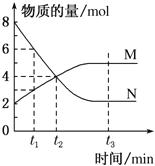
A.该反应的化学方程式为2M
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
难度: 中等查看答案及解析
-
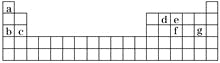
短周期元素
、
、
在周期表中的位置如图所示。已知
、
两元素的原子序数之和是
元素的4倍,则
、
、
分别是( )
A.
、
、
B.
、
、
C.
、
、
D.
、
、
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X2(g)+3Y2(g)
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
A.c(Z)=0.5 mol·L-1 B.c(Y2)=0.5 mol·L-1
C.c(X2)=0.2 mol·L-1 D.c(Y2)=0.6 mol·L-1
难度: 中等查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
Si(s)+4HCl(g);△H=+QkJ•mol-1 (Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强则化学反应速率降低
B.若反应开始时 SiCl4 为 1mol,则达到平衡时,吸收热量为 QkJ
C.反应至 4min 时,若HCl的浓度为 0.12mol•L-1,则 H2 的反应速率为 0.03mol/(L•min)
D.当反应吸收热量为 0.025QkJ 时,生成的 HCl 通入 100mL1mol•L-1 的 NaOH 恰好反应
难度: 简单查看答案及解析
-
铅蓄电池的两极分别为 Pb、PbO2,电解质溶液为 30% H2SO4 溶液,放电时的电池反应为Pb+PbO2+2H2SO4 = 2PbSO4+2H2O,下列说法正确的是( )
A.Pb 为正极,被氧化
B.溶液的 pH 不断减小
C.SO42- 向 PbO2 极移动
D.溶液的 pH 不断增大
难度: 简单查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
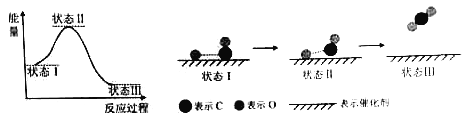
下列说法中正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ →状态Ⅲ表示CO与O2反应的过程
难度: 中等查看答案及解析
-
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数) ( )
A.若R(OH)m为强碱,则W(OH)n也为强碱
B.若HXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
难度: 中等查看答案及解析
-
已知R2+核内共有N个中子,R的质量数为A,确定m g R2+中含有电子的物质的量为( )
A. m(A-N)/A mol B. m(A-N+2)/Amol
C. m(A-N-2)/A mol D. m(A+N-2)/A mol
难度: 中等查看答案及解析