-
化学与生活密切相关,下列说法正确的是
A.煤的气化是物理变化,是高效、清洁地利用煤的重要途径
B.新型冠状病毒肺炎病症较多的地区,人们如果外出归家,应立即向外套以及房间喷洒大量的酒精
C.港珠澳大桥使用高性能富锌底漆防腐,依据的是外加电流的阴极保护法
D.华为继麒麟 980 之后自主研发的 7m 芯片问世,芯片的主要成分是硅
难度: 简单查看答案及解析
-
设 NA 为阿伏加德罗常数的值,下列说法正确的是
A.某密闭容器中盛有 0.1molN2 和 0.3molH2,在一定条件下充分反应,转移电子的数目为 0.6NA
B.常温下,1L pH=9 的 CH3COONa 溶液中,发生电离的水分子数为 1×10−9 NA
C.14.0gFe 发生吸氧腐蚀生成 Fe2O3•xH2O,电极反应转移的电子数为 0.5NA
D.标准状况下,2.24L 丙烷含有的共价键数目为 1.1NA
难度: 简单查看答案及解析
-
由下列实验、现象以及由现象推出的结论均正确的是
选项
实验方法
现象
结论
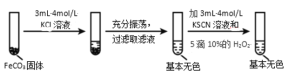
A
向 FeCl3 溶液中滴入少量 KI 溶液,再加入KSCN 溶液
溶液变红
Fe3+与 I-的反应具有可逆性
B
SO2 通入Ba(NO3)2 溶液
产生白色沉淀
白色沉淀是 BaSO4
C
将稀硫酸滴入淀粉溶液中并加热,冷却后再加入新制 Cu(OH)2 悬浊液并加热
未出现砖红色沉淀
淀粉未水解
D
用碎瓷片做催化剂,给石蜡油加热分解,产生的气体通过酸性高锰酸钾溶液
酸性高锰酸钾溶液逐渐褪色
石蜡油裂解一定生成乙烯
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
某种化合物的结构如图所示,其中 X、Y、Z、Q、W 为原子序数依次增大的五种短周期主族元素,Q 核外最外层电子数与 Y 核外电子总数相同,X 的原子半径是元素周期表中最小的。下列叙述正确的是
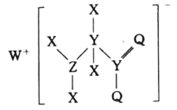
A.WX 的水溶液呈碱性
B.由 X、Y、Q、W 四种元素形成的化合物的水溶液一定呈碱性
C.元素非金属性的顺序为: Y>Z>Q
D.该化合物中与 Y 单键相连的 Q 不满足 8 电子稳定结构
难度: 简单查看答案及解析
-
下列说法正确的是
A.苯乙烯和苯均能使溴水褪色,且原理相同
B.用饱和 Na2CO3 溶液可鉴别乙醇、乙酸、乙酸乙酯
C.用 Ni 作催化剂,1mol
 最多能与 5molH2 加成
最多能与 5molH2 加成D.C3H6BrCl 的同分异构体数目为 6
难度: 简单查看答案及解析
-
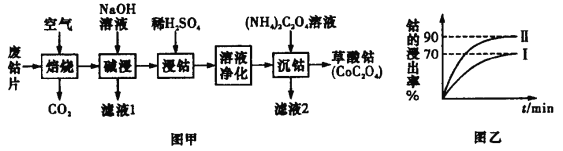
常温下,用 AgNO3 溶液分别滴定浓度均为 0.01 mol/L 的KCl、K2C2O4 溶液,所得的沉淀溶解平衡图像如图所示(不考虑 C2O42-的水解)。已知 Ksp(AgCl) 数量级为 10-10。下列叙述正确的是
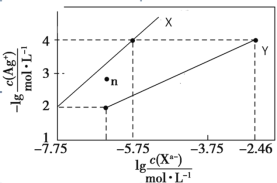
A.图中 Y 线代表的 AgCl
B.n 点表示 Ag2C2O4 的过饱和溶液
C.向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3溶液时,先生成 AgCl 沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为 10-0.71
难度: 中等查看答案及解析
-
环己酮(
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是

A.a 极与电源负极相连
B.a 极电极反应式是 2Cr3+- 6e- +14OH-= Cr2O72-+7H2O
C.b 极发生氧化反应
D.理论上生成 1mol 环己酮时,有 1molH2 生成
难度: 中等查看答案及解析

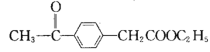 的合成路线图。________________
的合成路线图。________________