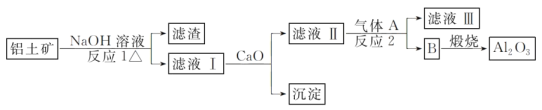
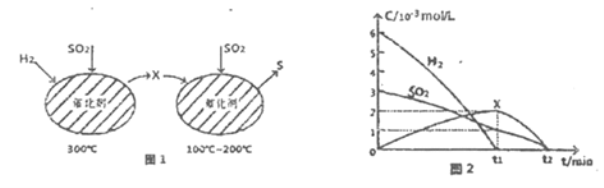
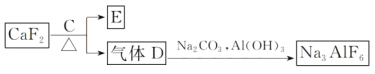-
中国传统诗词中蕴含着许多化学知识,下列分析不正确的是( )。
A. “日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象
B. “千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到
C. “爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应
D. “榆荚只能随柳絮,等闲缭乱走空园”,“柳絮”的主要成分为纤维素
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小
B. 铁管镀锌层局部破损后,铁管仍不易生锈
C. 反应活化能越高,该反应越易进行
D. 不能用红外光谱区分C2H5OH和CH3OCH3
难度: 中等查看答案及解析
-
向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A.碳酸钙粉末 B.稀硫酸 C.氯化钙溶液 D.二氧化硫水溶液
难度: 中等查看答案及解析
-
下列说法正确的是
A. 刚落下的酸雨随时间增加酸性逐渐增强,是由于雨水中溶解了CO2
B. 用浸泡过高锰酸钾溶液的硅藻土保鲜水果
C. 氧化性:HC1O>稀H2SO4,故非金属性:Cl>S
D. 将饱和FeCl3溶液煮沸至红褐色,可制得氢氧化铁胶体
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.14g聚丙烯中含C-H键总数目为2NA
B.常温下,pH=13的NaOH溶液中含有的OH-数目为0.1NA
C.100mL12mol·L-1浓硝酸与过量Cu反应转移电子的数目为0.6NA
D.电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2NA
难度: 中等查看答案及解析
-
下列实验操作或装置能达到目的的是( )
A
B
C
D

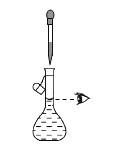
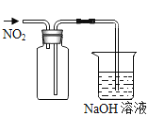
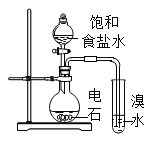
混合浓硫酸和乙醇
配制一定浓度的溶液
收集
气体
证明乙炔可使溴水褪色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.气体单质中,一定有σ键,可能有π键
B.PCl3分子是非极性分子
C.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高
D.ClO4-的VSEPR模型与离子的空间立体构型一致
难度: 中等查看答案及解析
-
[Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是( )
A.Zn2+基态核外电子排布式为[Ar]3d10
B.1molHCHO分子中含有σ键的数目为3mol
C.HOCH2CN分子中碳原子轨道的杂化类型是sp3
D.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,结构可表示为

难度: 中等查看答案及解析
-
肉桂酸(
)是一种合成有机光电材料的中间体。关于肉桂酸的下列说法正确的是
A.分子式为C9H9O2
B.不存在顺反异构
C.可发生加成、取代、加聚反应
D.与安息香酸(
)互为同系物
难度: 简单查看答案及解析
-
分子式为C5H12O,能与钠反应,且不含手性碳原子的有机化合物共有( )
A.8种 B.7种 C.6种 D.5种
难度: 困难查看答案及解析
-
N2O5在一定温度下可发生反应:2N2O5(g)
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s
0
500
1000
1500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
下列说法正确的是( )
A.500s内NO2的生成速率为2.96×10-3mol/(L·s)
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.平衡后,其他条件不变,将容器体积变为原来的
,则c(N2O5)<5.00mol/L
D.T1、T2温度下的平衡常数分别为K1、K2,若T1>T2,则K1>K2
难度: 中等查看答案及解析
-
在25℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,阴极逸出amol气体,同时有wgNa2SO4·10H2O晶体析出,若温度不变,剩余溶液的溶质质量分数是( )
A.
% B.
% C.
% D.
%
难度: 中等查看答案及解析