-
研究化学反应的热效应有利于更好的利用化学能。下列说法正确的是
A.升高温度可以增加分子的活化能
B.放热反应任何条件下一定能自发进行
C.生成物的键能总和大于反应物的键能总和的反应为放热反应
D.生成物总能量高于反应物总能量的反应为放热反应
难度: 简单查看答案及解析
-
根据以下三个热化学方程式:
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH=-Q1kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-Q2kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是(
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.工业上现在大规模采用电解熔融NaCl或AlCl3制取Na或Al
B.若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化
C.某反应的平衡常数K300℃>K350℃,则该反应 △H<0
D.合成氨生产中将NH3液化分离,目的是加快正反应速率,提高H2的转化率
难度: 中等查看答案及解析
-
下列过程属于非自发过程的是
A.N2和O2混合 B.H2和O2化合生成H2O
C.常温、常压下石墨转化为金刚石 D.C+O2=CO2
难度: 简单查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的一种制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O
Cu2O+H2↑。下列说法正确的是
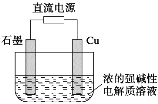
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
难度: 简单查看答案及解析
-
已知某温度下:N2(g)+3H2(g)
2NH3(g)△H=-92.4kJ/mol,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )
A.A中放热92.4kJ
B.B中放热46.2kJ
C.A中热量变化值大于B中2倍
D.A中热量变化值等于B中的2倍
难度: 中等查看答案及解析
-
已知Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是( )
A.该反应中旧键断裂需要吸收能量,新键形成需放出能量,所以总能量不变
B.上述热化学方程式中的ΔH的值与反应物的用量无关
C.该反应为放热反应
D.反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.用排饱和食盐水法收集Cl2
B.加压有利于合成氨反应
C.冰镇的啤酒打开后泛起泡沫
D.对2HI
H2+I2(g)平衡体系增加压强使颜色变深
难度: 简单查看答案及解析
-
下列说法正确的是
A.钢铁浸泡于食盐水中发生电化学腐蚀时的正极反应为:2H2O+2e-=H2↑+2OH-
B.增大气体压强或使用催化剂能能提高活化分子的百分数,从而加快反应速率
C.反应2CO(g)=2C(s)+O2(g) ΔS<0在任何条件下都不能自发进行
D.工业上合成氨反应N2(g)+3H2(g)
2NH3(g) ΔH<0采用高温是为了提高N2的平衡转化率
难度: 简单查看答案及解析
-
X、Y、Z、M、N代表五种金属。有以下化学反应:
①水溶液中:X+Y2+=X2++Y
②Z+2H2O(冷)=Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-=M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活动性由弱到强的顺序是
A.M<N<Y<X<Z B.N<M<X<Y<Z C.N<M<Y<X<Z D.X<Z<N<M<Y
难度: 简单查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
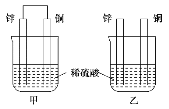
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a > c+d
难度: 中等查看答案及解析
-
如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是
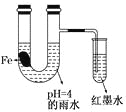
A.生铁片中所含的碳能增强铁的抗腐蚀性
B.雨水酸性较强,生铁片开始发生析氢腐蚀
C.导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D.随着反应的进行,U型管中雨水的酸性逐渐减弱
难度: 中等查看答案及解析
-
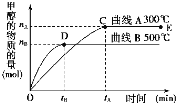
下列图示与对应的叙述不相符合的是( )
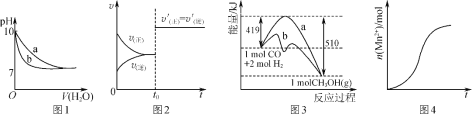
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)
CH3OH(g),该反应的ΔH=-91 kJ·mol-1
D.图4表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd +2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应为Cd(OH)2+2e—= Cd + 2OH-
C.放电时电池内部OH - 向正极移动
D.充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
难度: 中等查看答案及解析
-
相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X
Y
W
Z
反应体系能量变化
甲
2mol
1mol
放出a kJ/mol
乙
1mol
1mol
放出b kJ/mol
丙
2mol
2mol
放出c kJ/mol
丁
3mol
2mol
吸收d kJ/mol
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
难度: 中等查看答案及解析