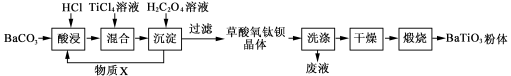
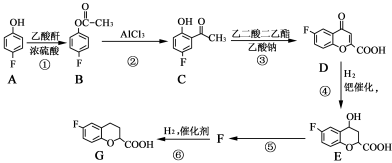
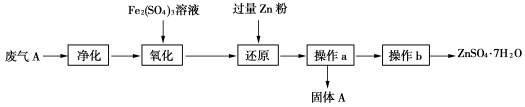
-
碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常的力学、电学和化学性能。

下列关于碳纳米管的说法不正确的是
A.碳纳米管属于一种有机合成纤维
B.碳纳米管与金刚石互为同素异形体
C.常温下,碳纳米管具有较好的稳定性
D.碳纳米管比表面积大,可用作新型储氢材料
难度: 中等查看答案及解析
-
下列有关化学用语的表示正确的是
A.N2的电子式:
B.CH4的比例模型:

C.中子数为45的溴原子:45 35Br
D.对羟基苯甲酸的结构简式:
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1CH3COONa溶液:H+、Al3+、Cl-、NO3-
B.含有NaNO3的溶液:H+、Fe2+、SO42- 、Cl-
C.能使甲基橙变红的溶液:K+、Na+、NO3-、Cl-
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
难度: 中等查看答案及解析
-
下列有关物质性质和应用的说法正确的是
A.碳酸钠受热易分解,可用于生产食品发酵粉
B.次氯酸钠具有强氧化性,可用于配制消毒液
C.二氧化硅不与强酸反应,可用石英玻璃容器盛放氢氟酸
D.二氧化硫有漂白、杀菌性能,可在食品生产中大量使用
难度: 中等查看答案及解析
-
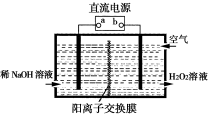
下列装置用于实验室以硫酸铝制取一定量Al2O3,能达到实验目的的是

难度: 中等查看答案及解析
-
用 NA表示阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,11.2 L 乙烯所含碳原子数为NA
B.1L 0.1 mol•L-1的Al2(SO4)3溶液中,Al3+的数目为0.2 NA
C.32g O2和 O3的混合气体中含有的氧原子数为2NA
D.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.氯气和水的反应:Cl2+H2O=2H++Cl-+ClO-
C.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2H2O
D.将过量二氧化硫通入氨水中:SO2+NH3·H2O=HSO3-+NH+4
难度: 中等查看答案及解析
-
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
物质
组别
甲
乙
丙
A
Mg
FeSO4
O2
B
Al2O3
HCl
NaOH
C
CO2
H2O
Na2O2
D
NaHCO3
Ca(OH)2
Na2CO3
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次递增。X的原子核中无中子;Y原子最外层电子数是内层的2倍;Z、W为同族元素,形成的WZ2分子是酸雨的主要成因。下列说法中正确的是
A.X与Y形成原子个数比为1∶1的化合物只有两种
B.Y、W的氧化物均为酸性氧化物
C.最高价氧化物对应水化物的酸性Y<W
D.X与Z形成的化合物中,各原子均满足8电子稳定结构
难度: 中等查看答案及解析
-
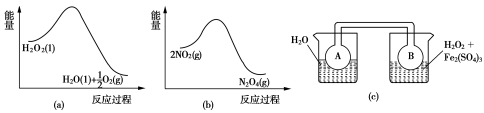
室温下,CuSO4·5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l) ΔH1>0;
CuSO4(s)=Cu2+(aq)+SO42-(aq) ΔH2<0。
若CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)
CuSO4(s) +5H2O(l),热效应为ΔH3。则下列判断正确的是
A.ΔH1<ΔH3 B.ΔH2>ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
难度: 中等查看答案及解析
-
下列说法正确的是
A.在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿
B.常温下,将pH= 4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.反应SiO2(s)+ 3C(s)=SiC(s) + 2CO(g)室温下不能自发进行,则该反应的△H<0
D.对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小
难度: 中等查看答案及解析
-
某有机物X的结构简式如下图所示,则下列有关说法中正确的是
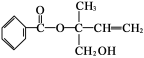
A.有机物X的分子式为C12H15O3
B.X分子中含有1个手性碳原子
C.X在一定条件下能发生加成、取代、消去等反应
D.在Ni作催化剂的条件下,1 mol X最多能与4 mol H2加成
难度: 中等查看答案及解析
-
在研究金属钠与水反应的实验中,下列根据实验现象得出的结论不正确的是
A.将一小块Na投入水中,钠浮于水面,说明钠密度比水小
B.将一小块Na投入滴有酚酞的水中,溶液变红,说明反应生成了碱
C.将一小块Na投入CuSO4溶液中,生成蓝色沉淀,说明Na没有Cu活泼
D.点燃Na与肥皂水反应产生的气泡,有尖锐爆鸣声,说明有H2生成
难度: 中等查看答案及解析
-
常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(
)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 NaHCO3溶液:c(Na+)+c(H+)=c(
)+c(
)+c(OH-)
C.0.1 mol·L-1Na2S溶液:2c(Na+) =c(S2-)+c(HS-) +c(H2S)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
氮氧化物与悬浮在大气中海盐粒子的相互反应:
4NO2(g)+2NaCl(s)
2NaNO3(s)+2NO(g)+ Cl2(g),ΔH
在恒温条件下,向2 L恒容密闭容器中加入0.4mol NO2和0.2 mol NaCl,10 min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为α。下列叙述中正确的是
A.10min内NO浓度变化表示的速率v(NO)=0.01 mol·L-1·min-1
B.若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于α
C.若升高温度,平衡逆向移动,则该反应的ΔH>0
D.若起始时向容器中充入NO2(g) 0.1 mol、NO(g)0.2 mol和Cl2(g)0.1 mol(固体物质足量),则反应将向逆反应方向进行
难度: 困难查看答案及解析