-
下列对硫酸的叙述正确的是( )
A.因浓硫酸具有强氧化性,故不可用它来干燥氢气
B.浓硫酸不活泼,可用铁铝容器存放
C.浓硫酸有强氧化性,稀硫酸不具有氧化性
D.浓硫酸难挥发,可用来制HF、HCl等挥发性酸
难度: 中等查看答案及解析
-
“塑料袋—想说爱你不容易!”商品零售场所塑料袋实行有偿使用,下列说法正确的是
A.聚丙烯塑料的结构简式为
B.聚氯乙烯塑料单体的电子式为
C.塑料购物袋的生产原料需要消耗大量木材
D.聚乙烯中含碳质量分数与其单体乙烯的含碳质量分数相同
难度: 简单查看答案及解析
-
下列有机物的命名正确的是
A.1,2─二甲基戊烷 B.3─甲基己烷
C.4─甲基戊烷 D.2─乙基戊烷
难度: 简单查看答案及解析
-
下列各个装置中铁棒被腐蚀由易到难的顺序正确的是
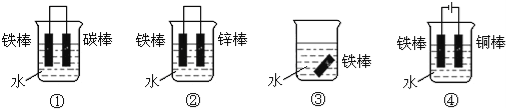
A.③①②④ B.④①③② C.①③②④ D.②④①③
难度: 中等查看答案及解析
-
下列事实能说明非金属性Cl>S的是
A.Cl2比S易与H2化合 B.酸性HClO3>H2SO3
C.酸性HCl>H2S D.Cl、S的最高正价分别为+7、+6
难度: 简单查看答案及解析
-
在无土栽培中需用浓度为0.5mol/L NH4Cl、0.16mol/L KCl、0.24mol/L K2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是( )
A.0.4mol、0.5mol、0.12mol B.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24mol D.0.64mol、0.02mol、0.24mol
难度: 中等查看答案及解析
-
元素A和B的原子序数都小于18。已知A元素原子最外层电子数为a,次外层电子数为b;B元素原子的M层电子数是a-b,L层电子数是a+b,则A、B两元素所形成的化合物的晶体类型为
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
难度: 中等查看答案及解析
-
下列物质在使用过程中体现了其氧化性的是
A.漂粉精用于消毒游泳池水 B.SO2用于漂白纸浆
C.明矾用于净水 D.NaOH溶液用于吸收Cl2
难度: 简单查看答案及解析
-
2.7g铝粉分别与体积均为100mL、浓度均为1.5mol/L的①硫酸溶液、②烧碱溶液、③盐酸完全反应,放出氢气的体积(相同条件)是
A.①=②=③ B.①=②>③ C.①>②>③ D.②>①=③
难度: 中等查看答案及解析
-
实验室制备乙炔的实验中,下列说法不正确的是
A.电石是块状固体,但取用时不可以直接用手拿
B.向烧瓶里加电石时,要使电石沿烧瓶内壁慢慢滑到瓶底,防止电石打破烧瓶
C.制乙炔常在导气管附近塞入少量棉花,它同实验室制氨气时使用棉花的作用一致
D.反应完毕后,应及时从水中取出导气管
难度: 简单查看答案及解析
-
如图为番茄电池的示意图,下列说法正确的是
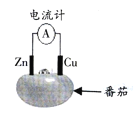
A.电流由锌通过导线流向铜
B.负极反应为Zn-2e-=Zn2+
C.一段时间后,铜片质量会减少
D.一段时间后,锌片质量会增加
难度: 中等查看答案及解析
-
下列液体不一定呈中性的是
A.pH=6的水 B.硝酸钾的水溶液
C.c(H+)=c(OH-)的某溶液 D.c(H+)=1×10-7mol/L的溶液
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.原子晶体中,共价键的键长越短,键能越大,熔点就越高
B.冰融化时,分子中
键发生断裂
C.分子晶体中,共价键键能越大,该分子的熔沸点就越高
D.分子晶体中,分子间作用力越大,则分子越稳定
难度: 中等查看答案及解析
-
在恒温恒容的容器中进行反应H2
2H-Q,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L,需反应的时间为
A.等于18s B.等于12s C.大于18s D.小于18s
难度: 简单查看答案及解析
-
常温下,将pH=2的HCl与pH=12的氨水等体积混合后,在所得的溶液中,下列关系式正确的是
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+) B.c(NH4+)>c(Cl-)>c(OH-)=c(H+)
C.c(NH4+)>c(Cl-)>c(H+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是 ( )
A.氯水中有平衡:Cl2+H2O
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对CO(g)+NO2(g)
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C.对2NO2(g)
N2O4(g), 升高温度平衡体系颜色变深
D.SO2催化氧化成SO3的反应,往往加入过量的空气
难度: 简单查看答案及解析
-
用标准氢氧化钠滴定未知浓度的盐酸,选用酚酞作为指示剂,下列操作会使滴定结果偏低的是
A.用蒸馏水洗净滴定管后,直接装入标准氢氧化钠进行滴定
B.滴定过程中,摇动时锥形瓶内的溶液溅出
C.盛装未知浓度盐酸的锥形瓶用蒸馏水洗过后未润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
难度: 简单查看答案及解析
-
在工业生产硫酸的过程中,发生如下反应:2SO2(g)+O2(g)
2SO3(g)+Q,下列叙述中,不正确的是:
A.矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快
B.接触室中采用常压的主要原因是常压下SO2的转化率已经很高
C.沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒
D.接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量
难度: 中等查看答案及解析
-
某学生做乙醛的还原性实验时,取0.2mol/LCuSO4溶液约0.2mL和2mol/LNaOH溶液4mL,在一支洁净的试管内混合后,向其中又加入约0.2mL40%的乙醛,结果无红色沉淀出现。导致该实验失败的原因可能是
A.未充分加热 B.加入乙醛太少
C.加入NaOH溶液的量太多 D.加入CuSO4溶液的量不够
难度: 简单查看答案及解析
-
现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法不正确的是

A.制取氨气时烧瓶中的固体常用CaO或NaOH
B.关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则C点时喷泉最剧烈
C.将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
D.该实验可以用来说明氨气在水中的溶解度很大
难度: 中等查看答案及解析
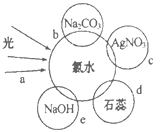


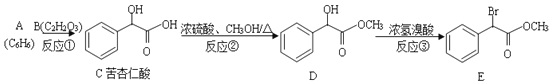
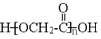 )的合成路线______。
)的合成路线______。