-
化学与社会、生产、生活密切相关。下列说法正确的是
A.石英只能用于生产光导纤维
B.复旦大学研究的能导电、存储的二维材料二硫化钼是一种新型有机功能材料
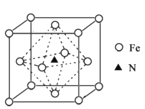
C.中国歼—20上用到的氮化镓材料是当作金属合金材料使用的
D.医用双氧水和酒精均可用于伤口清洗,两者消毒原理不相同
难度: 中等查看答案及解析
-
下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
难度: 困难查看答案及解析
-
下列说法中不正确的是
A.N2分子有一个δ键,两个π键
B.δ键比π键重叠程度大,形成的共价键强
C.电子排布图
 违背了洪特规则
违背了洪特规则D.气体单质中,一定有δ键,可能有π键
难度: 中等查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
A.
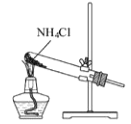 制取氨气 B.
制取氨气 B. 制取碳酸氢钠
制取碳酸氢钠C.
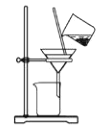 分离碳酸氢钠 D.
分离碳酸氢钠 D. 干燥碳酸氢钠
干燥碳酸氢钠难度: 中等查看答案及解析
-
下列与化学有关说法中正确的是( )
A.
和
互为同位素
B. lmol碳酸钾晶体中含阴离子数为等于NA个
C. 分子式为C4H8O2的羧酸共有3种
D. 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O
难度: 中等查看答案及解析
-
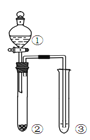
利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
实验装置
A
稀硫酸
Na2S
AgNO3与AgCl的溶液
Ksp(AgCl)>Ksp(Ag2S)
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2 溶液
SO2与可溶性钡盐均可以生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
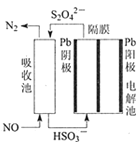
CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题。如图所示电解装置可将CO2 转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极。
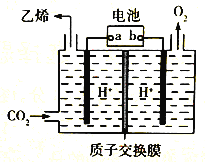
下列有关说法正确的是
A. a为电池的正极 B. 电解过程中H+移向阳极
C. 反应前后溶液的pH保持不变 D. 阴极反应式:2CO2+12H++12e-=C2H4+4H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.反应A(g)
2B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea- Eb)kJ/mol
B.常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同
C.某温度氯化钠在水中的溶解度是20 g,该温度饱和氯化钠溶液的质量分数为20%
D.将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,
始终保持增大
难度: 中等查看答案及解析
-
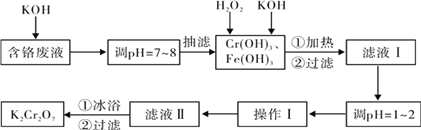
下列说法正确的是
A.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
B.可采取加热蒸发的方法使FeCl3从水溶液中结晶析出
C.NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
D.将SO2分别通入硝酸钡溶液和溶有氨气的氯化钡溶液中,产生沉淀的成分相同
难度: 中等查看答案及解析
-
常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A.pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B.往稀氨水中加水,
的值变小
C.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)=c(OH—)+2c(S2—)
D.Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
难度: 中等查看答案及解析