-
有① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
难度: 中等查看答案及解析
-
据最近报道,中国生产的首艘国产航母“山东”号已经下水。为保护航母、延长服役寿命可采用两种电化学方法。方法1:舰体镶嵌一些金属块;方法2:航母舰体与电源相连。下列有关说法正确的是( )
A. 方法1叫外加电流的阴极保护法
B. 方法2叫牺牲阳极的阴极保护法
C. 方法1中金属块可能是锌、锡和铜
D. 方法2中舰体连接电源的负极
难度: 简单查看答案及解析
-
合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在10~30MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%~15%;最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成氨。下列有关说法中错误的是
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成和哈伯法相比不需要在高温条件下,可节约大量能源
C.新法合成能在常温下进行也需要断裂化学键
D.新的催化剂降低了反应的活化能
难度: 中等查看答案及解析
-
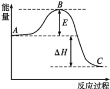
反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.
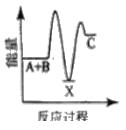 B.
B. 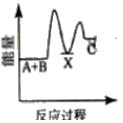
C.
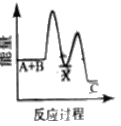 D.
D. 
难度: 中等查看答案及解析
-
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为
A.436kJ B.557kJ C.920kJ D.618kJ
难度: 中等查看答案及解析
-
已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+
H2(g)=
C2H2(g)ΔH2
③C(s)+ H2(g)=
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A.ΔH2 >ΔH3 >ΔH1 B.ΔH3 >ΔH2 >ΔH1
C.ΔH3 >ΔH1 >ΔH2 D.ΔH1 >ΔH2 >ΔH3
难度: 简单查看答案及解析
-
在25℃、101 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式书写正确的是()
A.CH3OH(l)+3/2O2(g)
CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B.2CH3OH(l)+3O2(g)
2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C.2CH3OH(l)+3O2(g)
2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D.2CH3OH(l)+3O2(g)
2CO2(g)+4H2O(l) ΔH=+1451.52 kJ·mol-1
难度: 中等查看答案及解析
-
在可逆反应2A(g)+3B(g)
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5∶3
B.x=1
C.2 min末时B的浓度为1.5 mol·L-1
D.2 min末时A的消耗浓度为0.5 mol·L-1
难度: 中等查看答案及解析
-
某温下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A.增大c(A)、c(B),K增大
B.降低温度,正反应速率增大
C.该反应的焓变为负值
D.该反应的化学方程式为2E(g)+F(g)
A(g)+2B(g)
难度: 中等查看答案及解析
-
一定温度下,可逆反应
在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2,同时生成2nmol
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成nmolO2,同时生成2nmolNO
⑤混合气体的颜色不再改变
⑥用
、NO、
的物质的量浓度变化表示的反应速率的比为2:2:1
A.①④⑤⑥ B.①②③⑤ C.②③④⑥ D.以上全部
难度: 简单查看答案及解析
-
据报导,我国已研制出“可充室温钠—二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠四甘醇二甲醚,电池总反应为:4Na+3CO2
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 放电时吸收CO2,充电时释放CO2
C. 放电时Na+向碳纳米管移动
D. 放电时的负极反应为2Na-2e-+CO32-=Na2CO3
难度: 中等查看答案及解析
-
某电池的简易装置图如下所示,a、b、y、x电极材料均为惰性电极,分别从A、B处通入乙醇和O2,用该装置进行实验,下列说法正确的是( )
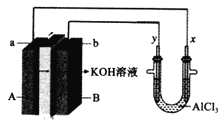
A. a电极反应式为C2H5OH+12OH――12e-=2CO2↑+9H2O
B. AlCl3溶液中的总反应为2Cl-+2H2O=Cl2↑+H2↑+2OH-
C. 反应开始后,观察到x电极附近出现白色沉淀
D. 左侧电池每通入32gO2,右侧电解池共生成2mol气体
难度: 中等查看答案及解析
-
下列反应中,一定不能自发进行的是
A.2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03 kJ/mol ΔS=1 110 J/(mol·K)
B.CO(g)===C(石墨,s)+1/2O2(g) ΔH=+110.5 kJ/mol ΔS=-89.36 J/(mol·K)
C.4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3 kJ/mol ΔS=-280.1 J/(mol·K)
D.NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=+37.301 kJ/mol ΔS=184.05 J/(mol·K)
难度: 中等查看答案及解析
-
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)
CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数不同
难度: 困难查看答案及解析
-
利用
可消除
的污染,反应原理为:
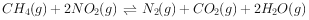 ,在10L密闭容器中分别加入
,在10L密闭容器中分别加入和
,测得不同温度下
随时间变化的有关实验数据如表所示:
组别
温度
时间
物质的量
0
10
20
40
50
M
下列说法正确的是
A.组别
中
内,
降解速率为
B.由实验数据可知温度
C.
时,表格中M对应的数据为
D.该反应只有在高温下才能自发进行
难度: 中等查看答案及解析
-
25℃时,0.1mol/L的3种溶液①盐酸②氨水③CH3COONa溶液。下列说法中,不正确的是( )
A. 3种溶液中pH最小的是①
B. 3种溶液中水的电离程度最大的是③
C. ①与②等体积混合后溶液显酸性
D. ①与③等体积混合后c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
难度: 中等查看答案及解析