-
2020年5月新修订的《北京市生活垃圾管理条例》将正式实施,垃圾分类并回收利用,可以减少污染,节约自然资源。下列垃圾投放有错误的是




A废旧报纸、饮料瓶、电池等
B剩饭菜、瓜皮
果壳、枯草落叶等
C过期药品、化妆品、油漆等
D一次性餐具、卫生纸、灰土等
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.氢氧根离子的电子式
B.NH3·H2O的电离NH3·H2O
NH4++OH-
C.S2-的结构示意图

D.间二甲苯的结构简式
难度: 简单查看答案及解析
-
下列不能用元素周期律原理解释的是
A.金属性:K>Na B.气态氢化物的稳定性:H2O>NH3
C.酸性:HCl>H2SO3 D.Br2从NaI溶液中置换出I2
难度: 简单查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
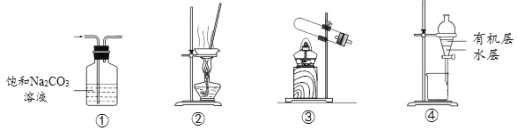
A.用①装置除去CO2中含有的少量SO2
B.用②装置蒸干饱和AlCl3溶液制备AlCl3晶体
C.用③装置加热NH4Cl固体制取NH3
D.用④装置分离乙酸乙酯与水的混合液
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列体系中指定微粒个数约为NA的是
A.0.5molCl2溶于足量水,反应中转移的电子
B.7.0g乙烯和丙烯混合气体中的氢原子
C.1L1mol/LNa2CO3溶液中含有的CO32-
D.标准状况下,5.6LCCl4含有的氯原子
难度: 中等查看答案及解析
-
下列说法不正确的是
A.高级脂肪酸甘油酯属于有机高分子化合物
B.紫外线、高温、酒精可杀菌消毒的原理是蛋白质变性
C.塑料、合成纤维、合成橡胶称为三大合成高分子材料
D.维生素C又称抗坏血酸,新鲜蔬菜中富含维生素C
难度: 简单查看答案及解析
-
阿魏酸是传统中药当归、川穹的有效成分之一,工业上合成阿魏酸的原理如下,下列说法不正确的是
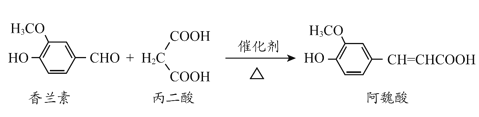 +H2O+CO2
+H2O+CO2A.阿魏酸分子式为C10H10O4
B.阿魏酸存在顺反异构
C.方程式中三种有机物均可与NaOH、Na2CO3反应
D.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
难度: 中等查看答案及解析
-
中国科学家在合成氨(N2+3H2
2NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。如图所示,下列说法不正确的是
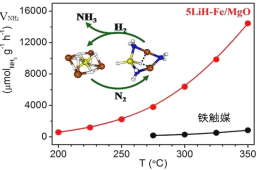
A.转化过程中有非极性键断裂与形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.低温下合成氨,能提高原料转化率
难度: 简单查看答案及解析
-
工业上用Na2SO3溶液吸收硫酸工业尾气中的SO2,并通过电解方法实现吸收液的循环再生。其中阴、阳离子交换膜组合循环再生机理如图所示,下列有关说法中正确的是
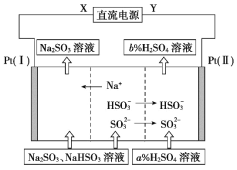
A.X应为直流电源的正极
B.电解过程中阴极区pH升高
C.图中的b%<a%
D.SO32-在电极上发生的反应为SO32-+2OH--2e-=SO42-+2H2O
难度: 中等查看答案及解析
-
亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用氯酸钠(NaClO3)为原料制取,(常温下ClO2为气态),下列说法错误的是

A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.反应①后生成的气体要净化后进入反应②装置
C.升高温度,有利于反应②提高产率
D.反应②中有气体生成
难度: 中等查看答案及解析
-
利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示,H+、O2、NO3-等共存物会影响修复效果。下列说法错误的是
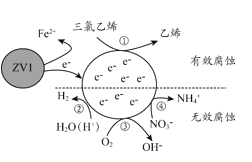
A.反应①②③④均为还原反应
B.1mol三氯乙烯完全脱Cl时,电子转移为3mol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.修复过程中可能产生Fe(OH)3
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验
现象
结论
A
向苯酚浊液中加入Na2CO3溶液
溶液变澄清
酸性:苯酚>碳酸
B
向20%蔗糖溶液中加入少量稀硫酸,加热;再加入银氨溶液并水浴加热
未出现银镜
蔗糖未水解
C
向2支盛有2mL相同浓度银氨溶液的试管中,分别加入2滴相同浓度的NaCl和NaI溶液
一支无明显现象,另一支产生黄色沉淀
相同条件下,AgI比
AgCl的溶解度小
D
C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液
KMnO4溶液褪色
乙烯能被KMnO4氧化
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
某同学探究温度对溶液pH值影响,加热一组试液并测量pH后得到如下数据(溶液浓度均为0.1mol/L):
温度(℃)
10
20
30
40
纯水
7.30
7.10
6.95
6.74
NaOH溶液
13.50
13.11
12.87
12.50
CH3COOH溶液
2.90
2.89
2.87
2.85
CH3COONa溶液
9.19
9.00
8.76
8.62
下列说法正确的是
A.随温度升高,纯水中的kw逐渐减小
B.随温度升高,NaOH溶液pH变化主要受水电离平衡变化影响
C.随温度升高,CH3COOH的电离促进了水的电离
D.随温度升高,CH3COONa溶液的pH减小,说明水解程度减小,c(CH3COO-)增大
难度: 中等查看答案及解析




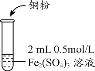
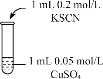
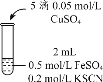
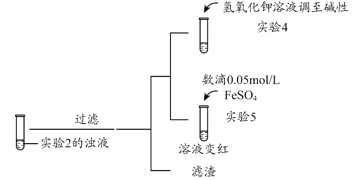
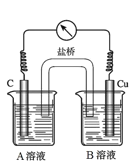
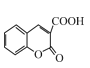 是一种重要的香料,常用作日常用品或食品的加香剂。
是一种重要的香料,常用作日常用品或食品的加香剂。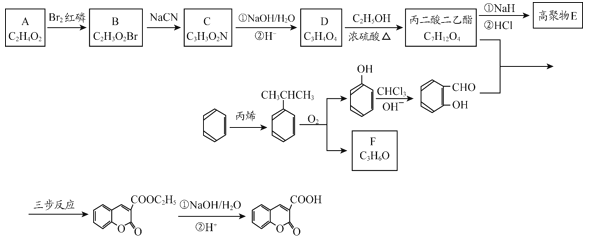
 +R1OH
+R1OH