-
下列说法正确的是
A.用苯萃取溴水中的Br2,分液时先从分液漏斗下口放出水层,再从上口倒出有机层
B.欲除去H2S气体中混有的HCl,可将混合气体通入饱和Na2S溶液
C.乙酸乙酯制备实验中,要将导管插入饱和碳酸钠溶液底部以利于充分吸收乙酸和乙醇
D.用pH试纸分别测量等物质的量浓度的NaCN和NaClO溶液的pH,可比较HCN和HClO的酸性强弱
难度: 中等查看答案及解析
-
下列有关叙述正确的是
①氧化镁:可用作耐火材料;②二氧化硅:制造计算机芯片;③水玻璃:可作木材防火剂;④铝热反应既可用于焊接钢轨,也可用于工业上冶炼铁;⑤水煤气属于清洁能源;⑥浓硫酸:可用于干燥Cl2、SO 2、H2S 等气体;⑦“84”消毒液主要成分为次氯酸钠,使用时加入浓盐酸可以增强消毒效果;⑧用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
A.②③④⑤ B.②④⑤⑥ C.①③⑤⑧ D.①③⑥⑦
难度: 中等查看答案及解析
-
常温下,将0.20 mol/LKMnO4酸性溶液 0.l0L与一定量pH=3.0的草酸(HOOC-COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.9 g HOOC-COOH含共用电子对数目为0.9NA
B.当0.01mol KMnO4 被还原时,强酸提供的H+数目为 0.01NA
C.pH=3.0的草酸溶液含有H+数目为0.001NA
D.该反应释放 CO2分子数目为VNA/22.4
难度: 中等查看答案及解析
-
阿巴卡韦(Abacavir) 是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体M(
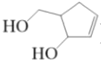 ),下列说法正确的是
),下列说法正确的是A.与环戊醇互为同系物 B.分子中所有碳原子共平面
C.和1 mol 钠反应可以生成 22.4 L 氢气 D.可用碳酸氢钠溶液鉴别乙酸和M
难度: 中等查看答案及解析
-
短周期元素原子半径与原子序数的关系如图,下列有关说法正确的是
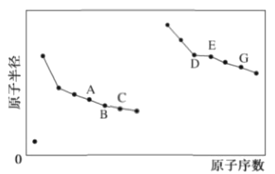
A.氢化物的热稳定性:C>B>A
B.简单离子半径大小:D>C
C.E的一种氧化物和A的单质在高温下能反应
D.G的最高价氧化物对应的水化物是离子化合物
难度: 中等查看答案及解析
-
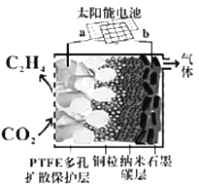
“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
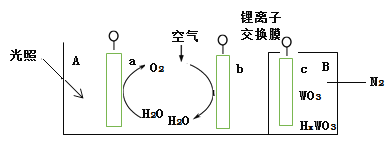
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
难度: 中等查看答案及解析
-
向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中
与
的关系如图所示,下列说法正确的是
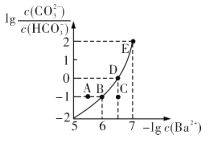
A.该溶液中
B.B、D、E三点对应溶液pH的大小顺序为B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+ ) +c(Na+ )+c(H+ )=c(CO32- )+c(OH- )+c(Cl- )
难度: 困难查看答案及解析


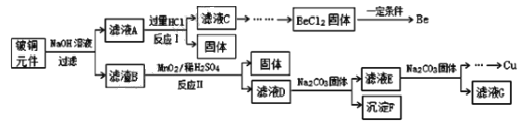
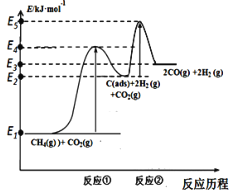
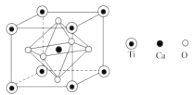
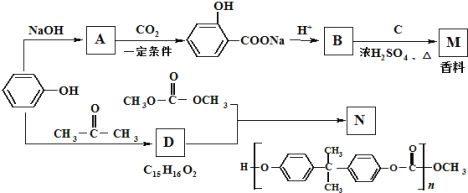
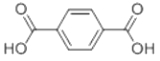 ,则符合下列条件的F的同分异构体有 ______种。
,则符合下列条件的F的同分异构体有 ______种。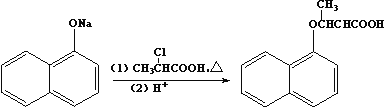 ,写出以苯酚、乙醇和ClCH2COOH为原料制备
,写出以苯酚、乙醇和ClCH2COOH为原料制备