-
下列说法中正确的是( )
A. ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B. 水很稳定是因为水中含有大量的氢键所致
C. H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C原子分别采取sp、sp2、sp3 杂化
D. 配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1
难度: 中等查看答案及解析
-
下列对一些实验事实的理论解释正确的是( )
选项
实验事实
理论解释
A
SO2溶于水形成的溶液能导电
SO2是电解质
B
白磷为正四面体分子
白磷分子中P-P键的键角是109°28′
C
1体积水可以溶解700体积氨气
氨是极性分子且分子间存在氢键影响
D
HF的沸点高于HCl
H-F的键长比H-Cl的短
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3﹣、dD﹣具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>C>D B.原子序数:d>c>b>a
C.离子半径:C3﹣>D﹣>B+>A2+ D.元素的第一电离能:A>B>D>C
难度: 中等查看答案及解析
-
通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半充满”、“全充满”的时候一般更加稳定,称为洪特规则的特例,下列事实能作为这个规则证据的是
①元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
②26Fe2+容易失电子转变为26Fe3+,表现出较强的还原性
③基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2
④某种激发态碳(C)原子电子排布式为1s22s12p3而不是1s22s22p2
A.①② B.②③ C.③④ D.全部
难度: 中等查看答案及解析
-
下列各项叙述中,正确的是( )
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.24Cr原子的电子排布式是1s22s22p63s23p63d44s2
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.电负性的大小可以作为判断元素金属性和非金属性强弱的尺度
B.在同一电子层上运动的电子,其自旋方向肯定不同
C.镁原子的核外电子排布由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
D.基态原子价层电子排布是5s1的元素,其氢氧化物的溶液一定不能溶解氢氧化铝
难度: 简单查看答案及解析
-
根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的立体构型正确的是( )
选项
分子式
中心原子
杂化方式
价层电子对
互斥模型
分子或离子
的立体构型
A
SO2
sp
直线形
直线形
B
HCHO
sp2
平面三角形
三角锥形
C
NF3
sp2
四面体形
平面三角形
D
NH4+
sp3
正四面体形
正四面体形
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
对应下列叙述的微粒M和N,肯定属于同主族元素且化学性质相似的是( )
A.原子核外电子排布式:M为1s22s2,N为1s2
B.结构示意图:M
,N
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
难度: 简单查看答案及解析
-
基态原子的核外电子排布式为[Kr]4d105s1 的元素在元素周期表中的位置是
A.p 区、第五周期第ⅠB 族 B.ds 区、第五周期第Ⅷ族
C.d 区、第四周期第ⅠB 族 D.ds 区、第五周期第ⅠB 族
难度: 简单查看答案及解析
-
铋的相关信息如图所示,下列说法正确的是( )
元素符号:Bi
原子序数:83
相对原子质量:209.0
价电子排布式:6s26p3
A.Bi 元素的质量数是 209
B.Bi 元素位于第六周期第ⅤA 族
C.Bi 原子的 6p 能级上有 1 个未成对电子
D.Bi 原子最外层有 5 个能量相同的电子
难度: 简单查看答案及解析
-
前四周期元素
、
、
、
、
的原子序数依次增大。
与
同周期且相邻,
的基态原子的
电子数与
电子数相等,乙是地壳中含量最多的金属元素,
的原子核外价电子排布式为
,
的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
A.简单气态氢化物的稳定性:
B.简单离子的半径:
C.
的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.由
、
、
三种元素形成的某种化合物可用于检查司机是否酒后驾车
难度: 中等查看答案及解析
-
某元素X的逐级电离能如图所示,下列说法正确的是( )
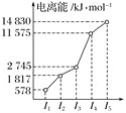
A.X元素可能为+4价 B.X可能为非金属
C.X为第五周期元素 D.X与氯反应时最可能生成的阳离子为X3+
难度: 简单查看答案及解析
-
如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是
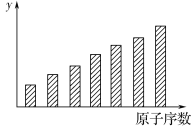
A.y轴表示的可能是第一电离能
B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径
D.y轴表示的可能是形成基态离子转移的电子数
难度: 中等查看答案及解析
-
如图所示为元素周期表中短周期的一部分,下列关于Y、Z、M的说法正确的是 ( )
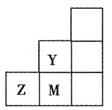
A.电负性:
B.离子半径:
C.
分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子的最外层电子排布图为
难度: 中等查看答案及解析
-
下表是
、
、
、
、
五种短周期元素的某些性质:
元素
A
B
C
D
E
最低负化合价
电负性
2.55
2.58
3.16
3.44
3.98
下列判断正确的是( )
A.
、
、
的简单氢化物的稳定性:
B.
元素原子的最外层原子轨道中无自旋状态相同的电子
C.
元素与
元素不可能形成化合物
D.与
元素同周期的第一电离能最小的元素的单质能与
发生置换反应
难度: 中等查看答案及解析
-
下列关于范德华力与氢键的叙述中正确的是( )
A.任何物质中都存在范德华力,而氢键只存在于含有 N、O、F 的物质中
B.范德华力比氢键的作用还要弱
C.范德华力与氢键共同决定物质的物理性质
D.范德华力与氢键的强弱都只与相对分子质量有关
难度: 简单查看答案及解析
-
下列有机物分子中有 3个手性碳原子的是( )
A.乳酸CH3—CHOH—COOH
B.甘油CH2OH—CHOH—CH2OH
C.脱氧核糖CH2OH—CHOH—CHOH—CH2—CHO
D.核糖CH2OH—CHOH—CHOH—CHOH—CHO
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.NH3 是极性分子,分子中 N 原子处在 3 个 H 原子所组成的三角形的中心
B.氨气易溶于水的原因之一是氨气分子与水分子之间能形成氢键
C.乙醇分子与水分子之间只存在范德华力
D.氯的各种含氧酸的酸性由强到弱的排列顺序为HClO>HClO2>HClO3>HClO4
难度: 简单查看答案及解析
-
下列各组物质中均存在离子键、极性键和配位键的是
A.氢氧化钠、过氧化钠、硫酸四氨合铜[Cu(NH3)4]SO4、氢化钠
B.硝酸铵、氢化铵、氢氧化二氨合银[Ag(NH3)2]OH、硫酸铵
C.硫酸、氢氧化钠、氮化钙、氢氧化钡
D.氯化铵、氢氧化钠、双氧水、过氧化钙
难度: 简单查看答案及解析
-
N2的结构可以表示为
,CO的结构可以表示为
,其中椭圆框表示 π键,下列说法不正确的是( )
A.N2 分子与 CO 分子中都含有三键
B.CO 分子中有一个 π 键是配位键
C.N2 与 CO 互为等电子体
D.N2 与 CO 的化学性质相同
难度: 简单查看答案及解析
-
下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是( )
A.CCl4、SiCl4、SiH4 B.H2S、NF3、CH4
C.BCl3、CH2===CHCl、环已烷 D.SO3、C6H6(苯)、CH3C≡CH
难度: 简单查看答案及解析
-
我国科学家研制出一种能在室温下高效催化空气中的甲醛氧化的催化剂,其反应如下:HCHO+O2
CO2+H2O。下列有关说法正确的是( )
A.反应物和生成物都是非极性分子
B.HCHO 的空间构型为四面体形
C.HCHO、CO2 分子的中心原子的杂化类型不同
D.液态水中只存在一种作用力
难度: 简单查看答案及解析
-
根据物质的溶解性“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中溶解度大,下列说明中正确的是()
A.溴、碘单质和四氯化碳中都含有卤素
B.溴、碘是单质,四氯化碳是化合物
C.Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子
D.以上说法都不对
难度: 中等查看答案及解析
-
短周期元素 X、Y、Z、W、Q 在元素周期表中的位置如表所示,其中 X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是( )
X
Y
Z
W
Q
A.X 与 Y 形成的化合物中一定不存在配位键
B.W 与 Q 可形成共价化合物 W2Q2
C.Q 的氢化物在熔融状态下能导电
D.H-Y 键的键能小于 H-W 键的键能
难度: 中等查看答案及解析
-
下列说法中,正确的有( )
A.卤素原子、羟基、羧基、苯基等都是官能团
B.碳原子数不同的两烷烃互为同系物
C.
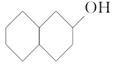 和
和互为同分异构体
D.
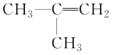 的名称是2-甲基-2-丙烯
的名称是2-甲基-2-丙烯难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.
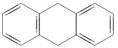 是苯的同系物
是苯的同系物B.Br-CH=CH-Cl分子中含有3种官能团
C.2,3-二甲基己烷的一氯代物有 8种
D.CH3-C≡C-CH(CH3)2 的名称是2-甲基戊炔
难度: 简单查看答案及解析
-
下列各组有机物中,既不互为同系物,又不互为同分异构体的是
A. CH3CH2CH2SCH2CH3与CH3CH2CH2CH2CH2SH
B.
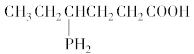 与
与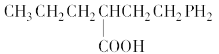
C.
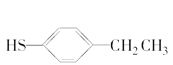 与
与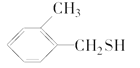
D.
与
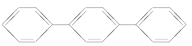
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.乙醇的结构简式可表示为 C2H6O
B.C3H6 和 C4H10 都有 2 种同分异构体
C.
分子中所有碳原子一定共平面
D.含5个碳原子的有机物,其分子中最多可形成 4个碳碳单键
难度: 简单查看答案及解析
-
分子式为C4H8Br2且分子中仅含有两个甲基的有机物共有(不考虑立体异构):
A. 2种 B. 3种 C. 4种 D. 5种
难度: 简单查看答案及解析
-
某有机物A的结构简式为:
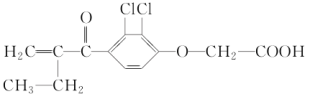
它是最早被禁用的兴奋剂之一,有关 A 的下列叙述不正确的是( )
A.有机物A由碳、氢、氧、氯四种元素组成
B.有机物A的化学式是 C13H12O4Cl2
C.有机物A可看作卤代烃也可看作芳香族化合物
D.有机物A分子中含有五种官能团
难度: 简单查看答案及解析
-
某有机物的结构简式为
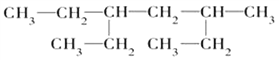 。下说法中不正确的是( )
。下说法中不正确的是( )A.该有机物属于饱和链烃 B.该有机物的名称是3-甲基-5-乙基庚烷
C.该有机物与2,5-二甲基-3-乙基己烷互为同系物 D.该有机物的一氯取代产物共有8种
难度: 简单查看答案及解析
-
某有机化合物的结构简式如图所示。关于该化合物的下列说法中正确的是( )
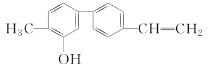
A.该有机物属于烯烃
B.该有机物属于醇
C.该有机物分子中所有的原子都共面
D.该有机物有两种官能团
难度: 简单查看答案及解析
-
下列有关有机物的官能团、核磁共振氢谱分析都正确的是( )
选项
有机物
官能团的名称
核磁共振氢谱峰数
A
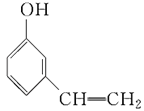
酚羟基、碳碳双键
5
B
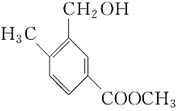
醇羟基、酯基
7
C
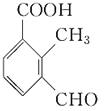
羧基、羰基
6
D
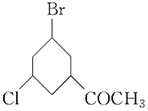
氯原子、溴原子、醛基
3
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.所有的有机物中都含有碳元素且都存在同分异构现象
B.互为同分异构体的有机化合物的结构简式一定不同
C.甲烷与氯气发生取代反应后的产物 CH2Cl2 有两种同分异构体
D.分子式为 CnH2n+2 和 CmH2m+2 的两烷烃一定互为同系物
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.丙烯的结构简式为 CH3CHCH2
B.结构为
的有机物的分子式为 C12H12
C.分子式为 C4H9Cl 的同分异构体共有 5 种
D.
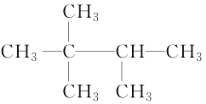 与(CH3)3CCH(CH3)2 不是同一物质
与(CH3)3CCH(CH3)2 不是同一物质难度: 简单查看答案及解析
-
下列关于有机物的说法不正确的是( )
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的戊烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥能够快速、微量、精确地测定相对分子质量的物理方法是核磁共振谱法
A.①②⑥ B.②③④
C.②④⑥ D.③⑤⑥
难度: 中等查看答案及解析
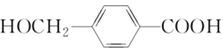 中含有的官能团为__________。
中含有的官能团为__________。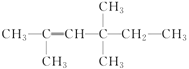 的系统命名为___________
的系统命名为___________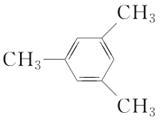 的名称为___________或___________
的名称为___________或___________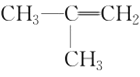 ⑦
⑦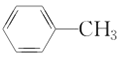 ⑧
⑧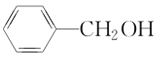 ⑨
⑨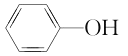 ,⑩CH3CH2Cl 中属于饱和烃的是___________,属于苯的同系物的是___________。互为同系物的是___________,互为同分异构体的是___________。
,⑩CH3CH2Cl 中属于饱和烃的是___________,属于苯的同系物的是___________。互为同系物的是___________,互为同分异构体的是___________。