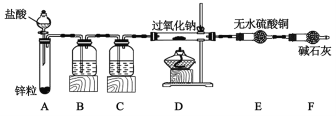
-
人类生产、生活中处处都有化学的身影,下列说法正确的是( )
A.燃放焰火必然会发生化学反应,故焰色反应属于某些金属元素的化学性质
B.水蒸气的液化、煤的液化都属于物质状态的改变,都属于物理变化
C.玻璃属于混合物、水玻璃属于纯净物
D.利用厨房中的食醋和纯碱可证明醋酸酸性强于碳酸
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,1mol乙烯和乙烷混合气体中,含碳原子数为NA
B.某温度下,1molCl2完全溶解在水中转移电子数为NA
C.22.4L由CO2和O2组成的混合气体中氧原子数为2NA
D.常温下,1LpH为13的NaOH溶液和Ba(OH)2混合溶液中含OH-个数为0.1NA
难度: 中等查看答案及解析
-
已知有机物M的结构简式如图,下列说法错误的是( )
A.M的分子式为C9H12
B.M与溴水、酸性高锰酸钾溶液反应原理不同
C.M中碳原子可能都处于同一平面
D.M和苯不互为同系物
难度: 中等查看答案及解析
-
下列有关实验的描述正确的是( )
选项
实验内容
现象或结论
A
向平衡体系FeCl3+3KSCN
Fe(SCN)3+3KCl中加入少量KCl固体
溶液颜色明显变浅
B
用NaOH溶液滴定盐酸(酚酞作指示剂)至终点
溶液由红色变为无色
C
二氧化硫通入到酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色,SO2具有还原性
D
将钠置于一定量的乙醇中
钠浮在液面上剧烈反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列操作中不能使指定物质或粒子的浓度增大的是( )
A.向AgCl悬浊液中加入少量Na2S固体,使溶液中Cl-浓度增大
B.向新制氯水中加入少量大理石,使HClO浓度增大
C.压缩平衡体系2NO2
N2O4的体积,使NO2浓度增大
D.向Fe(NO3)2溶液中,加入少量盐酸抑制Fe2+的水解,使Fe2+浓度增大
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W2-和X+的简单离子具有相同电子层结构,Z与X形成的离子化合物的水溶液呈中性,Y的原子序数是W的2倍。下列说法正确的是( )
A.原子半径:W<X<Z
B.W可分别与另三种元素形成两种或两种以上的二元化合物
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
利用电解法制取 Na2FeO4 的装置图如图所示,下列说法正确的是(电解过程中温度保 持不变,溶液体积变化忽略不计)
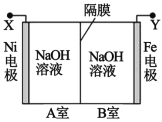
A.Y 是外接电源的正极,Fe 电极上发生还原反应
B.Ni 电极上发生的电极反应为:2H2O - 4e-== O2↑+4H+
C.若隔膜为阴离子交换膜,则电解过程中 OH-由 B 室进入 A 室
D.电解后,撤去隔膜,充分混合,电解液的 pH 比原来小
难度: 中等查看答案及解析