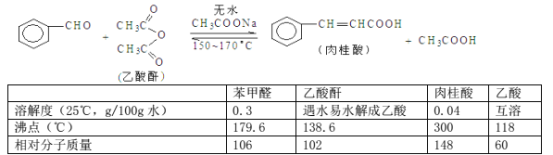
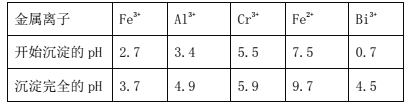
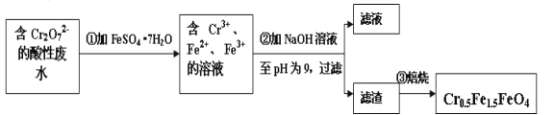
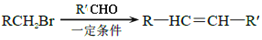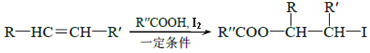-
化学与生产、生活密切相关,下列说法正确的是( )
A.含钙、钡、铁等金属元素的物质有绚丽的颜色,可用于制造焰火
B.将煤气化后再作为能源,可减少PM2.5引起的危害
C.用激光笔分别照射盛有蓝墨水、FeCl3溶液的玻璃杯均出现光亮的通路
D.氨气液化时能吸收大量的热,常用来做致冷剂
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molH2和0.1molI2(g)于密闭容器中充分反应,容器内原子总数为0.2NA
B.常温常压下,28gFe和足量浓硝酸混合,转移电子数为1.5NA
C.标准状况下22.4LHF中含有的氟原子数目为NA
D.2gD2O和H2l8O混合物中所含中子数为NA
难度: 简单查看答案及解析
-
下列关于有机物的说法,正确的是( )
A.由甲烷在纯氧中完全燃烧只生成CO2和H2O说明甲烷不含氧元素
B.
最多有16个原子共平面
C.油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
难度: 简单查看答案及解析
-
下列实验过程可以达到实验目的的是( )
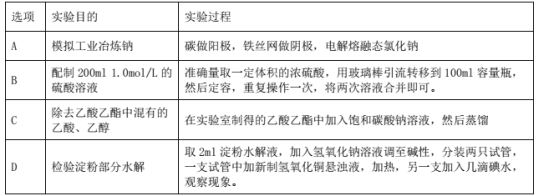
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
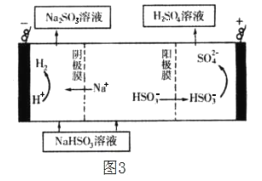
短周期主族元素X、Z、Y、P的原子序数逐渐增大。四种元素形成的化合物结构如图所示,其中各原子的核外电子排布均处于稳定结构。且X与Z、Y、P均可形成电子数相等的分子,X2P常温常压下为液体。下列说法不正确的是( )
A.X和P形成的化合物中可能存在非极性共价键
B.Z、Y、P的非金属性和最高价氧化物对应水化物的酸性都逐渐增强
C.Y的氢化物能和它的最高价氧化物对应水化物反应生成盐
D.X形成的简单离子半径不一定比Li+小
难度: 简单查看答案及解析
-
我国科学家在天然气脱硫研究方面取得了新进展,其原理如图所示。下列有关说法错误的是( )

A.图中导线上标记方向为电子流向
B.装置中H+向甲池迁移
C.正极上的电极反应式为O2+4H++4e-=2H2O
D.乙池溶液中发生反应的离子方程式:H2S+I3- =3I-+S↓+2H+
难度: 简单查看答案及解析
-
羟胺的电离方程式为:NH2OH+H2O
NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL0.lmol/L胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )

A.图中V1<10
B.A点对应溶液的pH=9.5
C.A、B、C、D四点中酸性最强的点为C点
D.E点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+2c(NH2OH)
难度: 中等查看答案及解析