-
化学与生活、生产、环境密切相关。下列说法错误的是( )
A.侯德榜制碱法制备NaHCO3的原理是利用溶解度较大的物质制备溶解度较小的物质
B.“雷雨肥庄稼”含义是N2最终转化成NO3-,此转化过程中氮元素被还原
C.“金柔锡柔,合两柔则为刚”中“金”为铜,说明合金的硬度一般大于各组分金属
D.我国科学家利用蜡虫肠道菌群将塑料降解的时间由500年缩减到24小时,有助于解决“白色污染”问题
难度: 中等查看答案及解析
-
某金属有机多孔材料FJI-H14在常温常压下对CO2具有超高的吸附能力,并能高效催化CO2与环氧乙烷衍生物的反应,其工作原理如图所示。下列说法不正确的是( )

A.该材料的吸附作用具有选择性
B.该方法的广泛使用有助于减少CO2排放
C.在生成
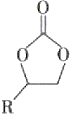 的过程中,有极性共价键形成
的过程中,有极性共价键形成D.其工作原理只涉及化学变化
难度: 中等查看答案及解析
-
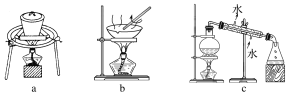
工业制汞的方法之一是辰砂(主要含HgS)焙烧法,焙烧辰砂时发生的主要反应为HgS+O2
Hg+SO2,生成的汞为气态,冷凝得液态汞。一种利用辰砂制备纯汞的流程如图所示。下列分析正确的是( )
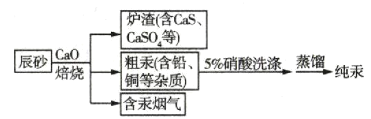
A.焙烧时加入CaO的主要目的是降低HgS的熔点
B.含汞烟气需除汞后才能排放到大气中
C.用5%的硝酸洗涤时发生的是物理变化
D.在实验室中进行蒸馏操作需要蒸馏烧瓶、冷凝管和分液漏斗等仪器
难度: 中等查看答案及解析
-
—种用于隐形眼镜材料的聚合物片段如图所示:
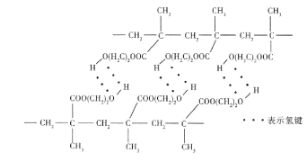
下列关于该聚合物的说法正确的是( )
A.结构简式为
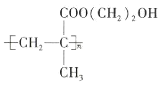
B.氢键是分子间作用力,对该高分子的性能没有影响
C.完全水解后得到的高分子有机物含有两种官能团
D.完全水解后得到的小分子有机物具有4种不同化学环境的氢原子
难度: 中等查看答案及解析
-
萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )
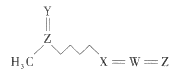
A.原子半径的大小顺序为Z>W>X>Y
B.X的简单氢化物与W的氢化物反应生成离子化合物
C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构
D.Y、Z形成的二元化合物的水化物为强酸
难度: 困难查看答案及解析
-
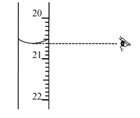
常温下,向20mL0.1mol·L-1NaHC2O4溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图所示。下列说法错误的是( )
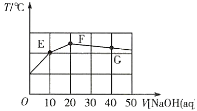
A.E点存在:2c(Na+)=3c(H2C2O4)+3c(HC2O4-)+3c(C2O42-)
B.F点存在:c(OH-)>c(H+)+c(HC2O4-)+c(H2C2O4)
C.在E、F和G点中,G点对应的Kw最小
D.G点对应的溶液中,c(Na+)>c(OH-)>c(C2O42-)>c(HC2O4-)
难度: 中等查看答案及解析
-
利用电解原理将SO2、NOx转化为(NH4)2SO4的装置如图所示。下列说法错误的是( )
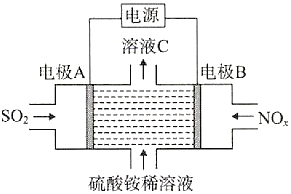
A.阴极的电极反应式:NOx+(2x+3)e-+(2x+4)H+=NH4++xH2O
B.溶液C的酸性比硫酸铵稀溶液强
C.电极A与电源的负极相连,发生氧化反应
D.转移0.2mol电子时消耗0.1molSO2
难度: 中等查看答案及解析
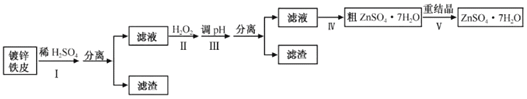


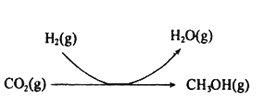
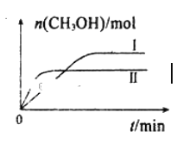
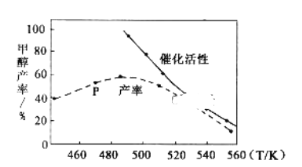
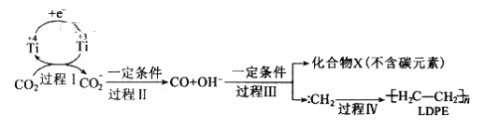
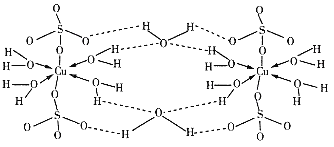
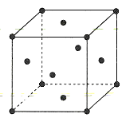
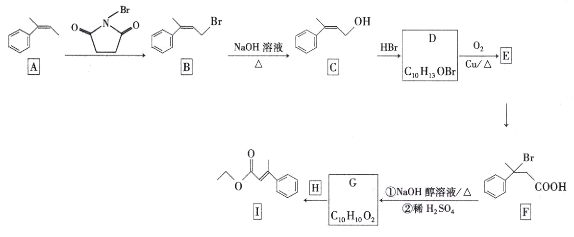
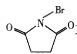 为原料制备丙二酸的合成路线:___(无机试剂任选)。
为原料制备丙二酸的合成路线:___(无机试剂任选)。