-
化学与科学、技术、社会密切相关。下列有关说法中正确的是
A.84 消毒液的有效成分是次氯酸钠
B.气氕、氘、氚都可用作“人造太阳”核聚变燃料
C.“中国天眼”使用的碳化硅属于硅酸盐材料
D.石墨烯是由单层碳原子构成的平面结构新型碳材料,属于烯烃
难度: 简单查看答案及解析
-
下列有关有机化合物的说法错误的是
A.葡萄糖和淀粉互为同系物
B.植物油含不饱和脂肪酸甘油酯,与氢气加成后生成固态的人造脂肪
C.对三联苯(
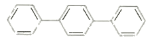 )分子中在同一直线上的原子最多有8个
)分子中在同一直线上的原子最多有8个D.分子式为C7H16的烷烃,最长碳链上有5个碳原子的同分异构体共有5种(不含立体异构)
难度: 简单查看答案及解析
-
下列离子方程式不能用来解释相应实验现象的是
选项
实验现象
离子方程式
A
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
Mg(OH)2+2NH4+
Mg2++2NH3·H2O
B
向酸性KMnO4溶液中滴加草酸钠溶液,紫色溶液褪色
2MnO4-+5C2O42-+8H2O=2Mn2++10CO2↑+16OH-
C
将二氧化硫通入足量的Ba(NO3)2溶液中,产生白色沉淀和无色气体(遇空气变红棕色)
3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+
D
氢氧化铁溶于HI溶液中
2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列有关实验操作的说法正确的是
A.用苯萃取溴水中的溴,分液时应从下口放出溴的苯溶液
B.中和热测定时环形玻璃搅拌棒要不断地顺时针搅拌,目的是为了混合均匀,充分反应
C.用滴定管量取溶液体积,若读数时放出液体前仰视,放出液体后俯视,则测量值小于真实值
D.用已知质量分数和密度的浓硫酸配制100 mL 1 mol· L-1H2SO4溶液,通常按计算值称量所需浓硫酸的质量.
难度: 简单查看答案及解析
-
X、Y、Z均为短周期主族元素,X和Y核外电子数之和等于Z核外电子数。Y为金属元素,其周期序字数等于族序数。单质Z在常温常压下是淡黄绿色气体,其氢化物在标准状况下呈液态。下列叙述错误的是
A.Y原子半径大于X
B.同族元素的氢化物中,Z的氢化物还原性最弱
C.X的最高价氧化物的水化物是一种两性氢氧化物
D.Y的氯化物中,原子的最外电子层不都满足8电子稳定结构
难度: 简单查看答案及解析
-
铅氧化还原液流电池是一种新型储能电池。该电池以酸性甲基磺酸铅溶液为电解液,简化的工作原理如图所示,下列说法正确的是
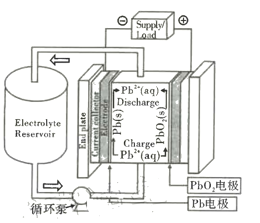
A.放电时,H+经过循环泵向Pb电极移动
B.放电时,负极反应式为Pb-2e- +SO42- = PbSO4
C.充电时,电解液中H+、Pb2+的物质的量浓度均减小
D.充电时,阳极反应式为Pb2+ +2H2O-2e- = PbO2 +4H+
难度: 中等查看答案及解析
-
25 C时,H2SO3的pKa1、pKa2(pK= -lgK)分别为1.89、7.20, NH3·H2O的pKb为4.72。常温时,下列指定溶液中粒子物质的量浓度关系正确的是
A.pH=3的H2SO3溶液中,c(HSO3 -) +2c(SO3-)=1 ×10-3 mol·L-1
B.0.1 mol·L-1H2SO3溶液用NaOH溶液滴定至pH =7.20, c( HSO3 ) =2c(SO3- )
C.0.1 mol.L-1H2SO3溶液用氨水滴定至pH=7.0, c(NH4+) =c(HSO3-) +c(SO32- )
D.0.1 mol·L-1NH4HSO3溶液中: c(NH4+ ) >c(H+) >c( NH3·H2O)
难度: 中等查看答案及解析
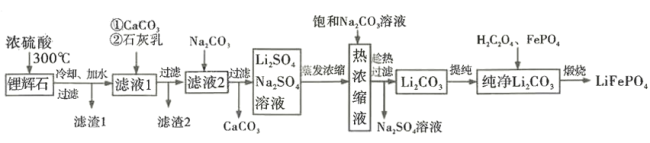
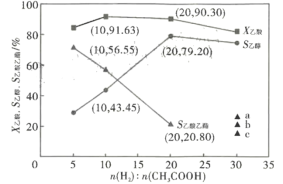
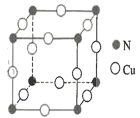
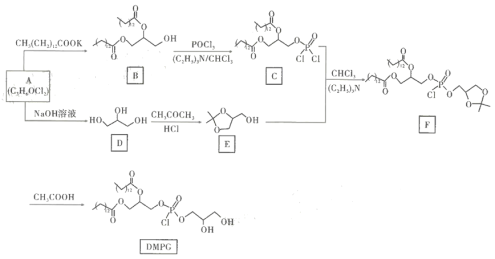
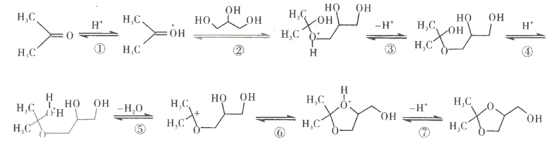
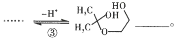 ____________
____________