-
2019年7月1日起,上海进入垃圾分类强制时代,随后西安等地也纷纷开始实行垃圾分类。这体现了我国保护环境的决心,而环境保护与化学息息相关,下列有关说法正确的是
A.废弃的聚乙烯塑料属于白色垃圾,不可降解,能使溴水褪色
B.可回收的易拉罐中含金属铝,可通过电解氯化铝制取
C.废旧电池中含有镍、镉等重金属,不可用填埋法处理
D.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O
难度: 中等查看答案及解析
-
下列有关元素周期表和元素周期律的说法,错误的是
①元素周期表中s区、d区和ds区的元素都是金属元素
②d区元素最后一个核外电子一定填充在s能级上
③原子核外电子的能层越多,原子半径越大
④同一周期自左至右,元素的第一电离能依次增大
A.只有①②③ B.只有②③ C.只有③④ D.①②③④
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法错误的是
A.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
B.在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212g氯气生成,则反应中电子转移的数目为5NA
C.16gO2和14C2H4的混合物中所含中子数为8NA
D.常温下,1L0.5mol/LCH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
难度: 困难查看答案及解析
-
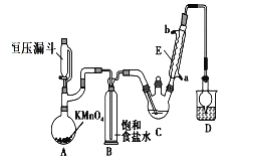
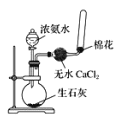
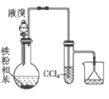
下列图示实验正确的是
A.制取蒸馏水

B.制取收集氨气
C.实验室制取溴苯
D.碳酸氢钠受热分解

难度: 简单查看答案及解析
-
下列有关说法不正确的是( )
A.天然油脂都是混合物,没有恒定的熔点和沸点
B.用饱和Na2CO3溶液可以除去乙酸乙酯中的乙酸
C.
的名称为2-乙基丙烷
D.有机物
分子中所有碳原子不可能在同一个平面上
难度: 中等查看答案及解析
-
下列离子方程式书写及评价合理的是下列离子方程式书写及评价合理的是( )
离子方程式
评价
A
Mg(HCO3)2溶液中加入足量的NaOH溶液
Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O正确,NaOH过量,酸式盐与碱完全反应生成正盐和水;
B
1mol/L的NaA1O2溶液与2.5mol/L的HCl溶液等体积混合2A1O2+5H+=A13++Al(OH)3+H2O
正确,A1O2-与H+按物质的量1:1反应转化为Al(OH)3,过量的H+再将一半Al(OH)3转化为Al3+
C
将少量的Fe3O4溶解在过量的稀HNO3中
Fe3O4+8H+=Fe2++2Fe3++4H2O正确,Fe3O4化学式可改写为FeO•Fe2O3,Fe2+与Fe3+,物质的量之比为1:2
D
将FeCl2溶液加入到NaClO洛液中Fe2++2C1O-+2H2O=Fe(OH)2↓+2HClO
错误,Fe2+与C1O-会发生氧化还原反应:2Fe2++C1O-+5H2O=2Fe(OH)3↓+Cl-+4H+
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
X、Y、Z、Q、E、M六种元素中,X的原子的基态价电子排布式为2s2,Y的基态原子核外有5种运动状态不同的电子,Z元素的两种同位素原子通常作为示踪原子研究生物化学反应和测定文物的年代,Q是元素周期表中电负性最大的元素,E的阳离子通常存在于硝石、明矾和草木灰中,M的原子序数比E大1。下列说法正确的是
A.EYQ4 中阴离子中心原子的杂化方式为sp3杂化
B.X、Y元素的第一电离能大小关系:X<Y
C.ZO32-的空间构型为V形
D.MZ2仅含离子键,可用于制备乙炔
难度: 困难查看答案及解析
-
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的产量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b。
③常温下,AgCl在同物质的量浓度的氨水和NaCl溶液中的溶解度比较,前者大。
④若将适量CO2通入0.1 mol/LNa2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+ c(HCO3ˉ)= 0.1 mol/L
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
A.①②④⑤ B.②④⑤ C.②⑤ D.①③⑤
难度: 中等查看答案及解析
-
下列设计的实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
探究化学反应的
限度取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
B
探究浓度对化学反应速率的影响
用两支试管各取5mL0.1mol/L的KMnO4溶液,分别加入2mL0.1mol/L和0.2mol/L的草酸溶液,记录溶液褪色所需的时间
C
证明溴乙烷的消去反应有乙烯生成
将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入酸性KMnO4溶液中
D
验证醋酸钠溶液中存在水解平衡
取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体其水溶液呈中性,观察溶液颜色变化
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是 ( )
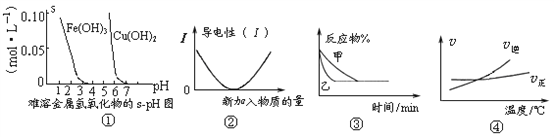
A. 根据图①溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量Cu,至pH在4左右。
B. 图②可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
C. 图③表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强大
D. 根据图④可判断可逆反应A2(g)+3B2(g)
2AB3(g)的化学平衡常数K随温度升高而变小
难度: 困难查看答案及解析
-
铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是( )
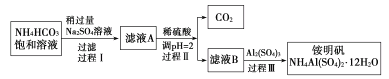
A.过程Ⅰ反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4
B.检验溶液B中阴离子的试剂仅需BaCl2溶液
C.若省略过程Ⅱ,则铵明矾产率明显减小
D.向铵明矾溶液中逐滴加入NaOH溶液并加热,先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
难度: 中等查看答案及解析
-
“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
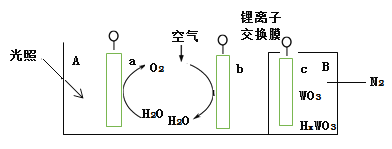
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
难度: 中等查看答案及解析


 ),写出合成路线图(无机试剂自选)_________。
),写出合成路线图(无机试剂自选)_________。