-
在3NO2+H2O=2HNO3+NO中,氧化剂与还原剂的分子个数比为
A.2∶1 B.1∶2 C.3∶1 D.1∶3
难度: 中等查看答案及解析
-
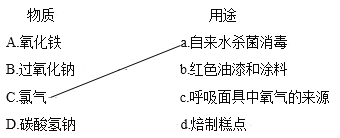
合金是一类用途广泛的金属材料。下列物质不属于合金的是
A.不锈钢 B.青铜 C.生铁 D.水银
难度: 简单查看答案及解析
-
下列物质中,属于电解质的是
A.Cu B.NaCl溶液 C.NaOH固体 D.乙醇
难度: 简单查看答案及解析
-
下列微粒中,既具有氧化性又具有还原性的是( )
A.Fe2+ B.O2 C.Cl- D.Na
难度: 简单查看答案及解析
-
下列物质的电子式书写正确的是( )
A.Cl:Cl B.
C.
D.
难度: 简单查看答案及解析
-
下列四种基本反应类型与氧化还原反应的关系图中,正确的是( )
A.
 B.
B.
C.
 D.
D.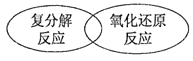
难度: 简单查看答案及解析
-
在元素周期表中金属与非金属的分界处,可以找到( )
A.合金 B.农药 C.催化剂 D.半导体材料
难度: 简单查看答案及解析
-
下列元素中,原子半径最大的是
A.Na B.Mg C.Al D.Si
难度: 简单查看答案及解析
-
重水(2H2O)是重要的核工业原料,下列说法不正确的是
A.氘(2H)原子核内有1个质子 B.1H与2H是不同的核素
C.1H218O与2H216O的相对分子质量相同 D.1H2O与2H2O互为同位素
难度: 中等查看答案及解析
-
下列各组离子中,能在溶液里大量共存的是( )
A.H+、Na+、SO42-、Cl- B.Ca2+、Na+、CO32-、NO3-
C.K+、Fe3+、OH-、SO42- D.Na+、H+、HCO3-、Cl-
难度: 简单查看答案及解析
-
下列溶液中的c(SO42-)与50mL1mol·L-1Al2(SO4)3溶液中的c(SO42-)相等的是
A.150mL1mol·L-1Na2SO4溶液
B.75mL2mol·L-1(NH4)2SO4溶液
C.150mL3mol·L-1K2SO4溶液
D.20mL1.5mol·L-1Fe2(SO4)3溶液
难度: 简单查看答案及解析
-
在标准状况下,下列物质体积最大的是( )
A.3gH2 B.6.02×1023个H2 C.44.8LH2 D.0.5molH2
难度: 简单查看答案及解析
-
下列说法中,符合VIIA族元素结构与性质特征的是( )
A.原子易形成-2价阴离子
B.单质均为双原子分子,具有氧化性
C.原子半径随原子序数递增逐渐减小
D.氢化物的稳定性随原子电子层数递增依次增强
难度: 简单查看答案及解析
-
下列有关试剂保存的说法中,不正确的是( )
A.新制氯水保存在棕色试剂瓶中
B.金属Na保存在煤油中
C.漂白粉保存在敞口容器中
D.过氧化钠应密封保存
难度: 简单查看答案及解析
-
下列关于Na2CO3和NaHCO3性质的说法中,不正确的是( )
A.热稳定性:Na2CO3>NaHCO3
B.相同温度下,溶解度:Na2CO3>NaHCO3
C.等质量的Na2CO3和NaHCO3最多产生CO2的量:Na2CO3<NaHCO3
D.等物质的量的Na2CO3和NaHCO3最多消耗盐酸的量:Na2CO3<NaHCO3
难度: 简单查看答案及解析
-
用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是
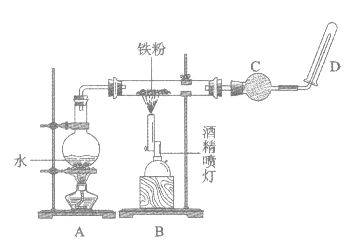
A. 装置A的作用是为实验提供持续不断的水蒸气
B. 装置B中反应的化学方程式是2Fe+3H2O
Fe2O3+3H2↑
C. 装置C中加入的固体干燥剂可能是碱石灰
D. 点燃D处的气体前必须检验气体的纯度
难度: 中等查看答案及解析
-
下列说法正确的是
A.NaCl的摩尔质量是58.5 g
B.标准状况下,22.4 L水中约含6.02×1023个H2O分子
C.常温常压下,22 g CO2中所含氧原子数约为6.02×1023
D.将40 g NaOH固体溶于1 L H2O中,得到1 mol/L的NaOH溶液
难度: 简单查看答案及解析
-
反应条件与环境对化学反应会产生影响,下列说法错误的是( )
化学反应
影响因素
A
过氧化氢不稳定,向溶液中加入少量MnO2后分解速率明显加快
催化剂
B
Na与O2反应既能生成Na2O也能生成Na2O2
温度
C
20mL过氧化氢比10mL过氧化氢产生更多的O2
浓度
D
过氧化氢在酸、碱、中性条件下将高锰酸钾分别还原成Mn2+、MnO42-、MnO2
溶液的酸碱性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列除去杂质(括号中的物质为杂质)的方法中,不正确的是
A.FeCl3溶液(FeCl2):通入适量Cl2
B.Fe2O3固体(Al2O3):加入足量的盐酸,过滤
C.CO气体(CO2):通过NaOH溶液洗气后干燥
D.Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥
难度: 中等查看答案及解析
-
某元素原子的结构示意图为
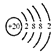 ,由此得到的结论正确的是( )
,由此得到的结论正确的是( )A.元素符号是K
B.原子半径小于Mg
C.在化学反应中易得电子
D.在周期表中的位置是第四周期IIA族
难度: 简单查看答案及解析
-
下列反应的描述与离子方程式均正确的是( )
A.锌片插入硝酸银溶液中,有银析出:Zn+Ag+=Zn2++Ag
B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C.将盐酸加入到氢氧化铜中,无明显现象:Cu(OH)2+2H+=Cu2++2H2O
D.将盐酸加入到碳酸钡中,固体溶解,生成无色无味气体:BaCO3+2H+=Ba2++CO2↑+H2O
难度: 简单查看答案及解析
-
在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是( )
选项
方法
现象
结论
A
观察氯水颜色
氯水呈黄绿色
氯水中含Cl2
B
向饱和NaHCO3溶液中加入足量氯水
有无色气体产生
氯水中含HClO
C
向红色纸条上滴加氯水
红色纸条褪色
氯水具有漂白性
D
向FeCl2溶液中滴加氯水
溶液变成棕黄色
氯水具有氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列各组反应,最终一定能得到白色沉淀的是( )
A.向CaCl2溶液中通入少量CO2
B.向CuSO4溶液中加入足量NaOH溶液
C.向FeCl2溶液中加入足量NaOH溶液
D.向MgSO4溶液中加入足量NaOH溶液
难度: 简单查看答案及解析
-
碱金属元素钫(Fr)具有放射性。下列对其性质的预言中,不正确的是( )
A.它的金属性比Na强,跟水反应更剧烈
B.它的原子半径比Na大,离子半径也比Na+大
C.它与硫酸铜溶液发生置换反应得到金属铜
D.它的氢氧化物(FrOH)是一种强碱,使酚酞溶液变红
难度: 简单查看答案及解析
-
向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是:(已知氧化性:Fe3+>Cu2+)( )
A.溶液中一定含有Cu2+
B.加入KSCN溶液一定不变红色
C.溶液中一定含有Fe2+
D.剩余固体中一定含铜
难度: 中等查看答案及解析
-
某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
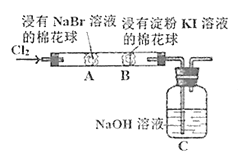
A.A处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.B处棉花球变成蓝色,说明Br2的氧化性比I2强
C.A处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2
D.C装置中与NaOH溶液反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O
难度: 简单查看答案及解析
-
下列反应所得溶液中一定只含一种溶质的是( )
A.向AlCl3溶液中加入一定量的NaOH
B.向NaOH溶液中通入足量CO2气体(不考虑CO2溶于水)
C.向含1molNaHCO3溶液中,加入1molNa2O2粉末
D.向含1molNa2CO3溶液中,加入含1molHCl的盐酸
难度: 简单查看答案及解析
-
下列“实验结论”与“实验操作及现象”相符的一组是( )
选项
实验操作及现象
实验结论
A
向某溶液中加入AgNO3溶液,有白色沉淀生成
该溶液中一定含有Cl-
B
向某溶液中加入稀盐酸,有无色气体产生
该溶液中一定含有CO32-
C
向某溶液中加入BaCl2溶液,有白色沉淀生成
该溶液中一定含有SO42-
D
向某溶液中加入NaOH溶液,立即产生红褐色沉淀
该溶液中一定含有Fe3+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
高铁酸钠(Na2FeO4)是一种高效的饮用水处理剂,工业上可由下列方法制得:Fe2O3+3Na2O2
2Na2FeO4+Na2O,下列关于该反应的说法中正确的是( )
A.反应中Na2O2既是氧化剂又是还原剂
B.Fe2O3可以通过铁丝在氧气中燃烧制得
C.生成1molNa2FeO4,有3mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒
难度: 简单查看答案及解析