-
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应为:C2H6+18OH——14e—=2CO32—+12H2O 7H2O+7/2O2+14e—=14OH—。有关此电池的推断错误的是
A. 通氧气的电极为正极 B. 参加反应的O2与C2H6的物质的量之比为7:2
C. 放电一段时间后,KOH的物质的量浓度将下降 D. 在电解质溶液中CO32—向正极移动
难度: 中等查看答案及解析
-
2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理的是
A. 第35号元素的单质在常温常压下是液体
B. 位于第四周期第ⅤA族的元素为非金属元素
C. 第84号元素的最高化合价是+7
D. 第七周期0族元素的原子序数为118
难度: 困难查看答案及解析
-
同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是:HAO4>H2BO4>H3CO4,则下列判断错误的是
A.原子半径A>B>C B.气态氢化物稳定性HA>H2B>CH3
C.非金属性A>B>C D.阴离子还原性C3—>B2—>A—
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子的最外层电子数之和为12,Y、Z、W位于同一周期,Z原子的最外层电子数既是X原子内层电子总数的3倍,又是Y原子最外层电子数的3倍。下列说法不正确的是( )
A.原子半径:Y>X,离子半径Z<W
B.元素Y的单质能与元素X的最高价氧化物发生置换反应
C.元素Y和W能形成YW2型离子化合物
D.W的单质有毒,能使湿润的有色布条褪色
难度: 中等查看答案及解析
-
下列各组化合物中,化学键类型完全相同的是:( )
A.HCl 和NaOH B.Na2O 和Na2O2
C.CO2和 CaO D.CaCl2和 Na2S
难度: 简单查看答案及解析
-
根据下列事实:①A+B2+=A2++B;②E+2H2O=E(OH)2↓+H2↑;③以B、D为电极与D的盐溶液组成原电池,电极反应为:D2++2e﹣=D,B﹣2e﹣═B2+.由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是( )
A.D2+>B2+>A2+>E2+ B.B2+>A2+>D2+>E2+
C.D2+>E2+>A2+>B2+ D.E2+>B2+>A2+>D2+
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.双原子分子中的共价键一定是非极性键
B.任何原子的原子核都是由质子和中子构成的
C.非极性键可能存在于离子化合物中
D.质子数相同的微粒,它们的化学性质基本相同
难度: 简单查看答案及解析
-
下列分子中所有原子都满足最外层8电子稳定结构的是( )
A.BeCl2 B.CH4 C.BF3 D.PCl3
难度: 简单查看答案及解析
-
中和热测定实验中,下列操作会使测得的∆H偏小的是( )
A.大烧杯上没有盖硬纸板
B.用环形铜丝搅拌棒代替环形玻璃搅拌棒
C.用相同浓度和体积的硝酸代替稀盐酸溶液进行实验
D.用1gNaOH固体代替50mL0.5mol/L的NaOH溶液进行实验
难度: 简单查看答案及解析
-
已知X为第三周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
A.X元素最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物的化学式一定为H2X
C.X的单质一定是良好的半导体材料
D.X元素的氧化物一定能与烧碱反应
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.固态Na2O2和熔融态NaHSO4中的阴、阳离子个数比不同
B.每个水分子内含有两个氢键
C.碘晶体受热转变成碘蒸气,破坏了共价键
D.干冰溶于水生成碳酸的过程只需克服分子间作用力
难度: 简单查看答案及解析
-
下列化学用语的书写,正确的是( )
A.氯原子的结构示意图:
B.6个质子8个中子的碳元素的核素符号:12C
C.氯化镁的电子式:[
]-Mg2+[
]-
D.用电子式表示氯化氢的形成过程:H·+·
-→H+[
]-
难度: 简单查看答案及解析
-
决定化学反应速率的主要因素是 ( )
①温度 ②压强 ③催化剂 ④浓度 ⑤反应物本身的性质
A.①②③④⑤ B.⑤ C.①④ D.①②③④
难度: 简单查看答案及解析
-
在可逆反应CO(g)+H2O(g)
CO2(g)+H2(g)(正反应为放热反应)中,改变下列条件,不能使v正增大的是( )。
A.升高温度 B.降低温度 C.使用催化剂 D.增大CO浓度
难度: 中等查看答案及解析
-
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是( )

A. C(s、石墨)==C(s、金刚石)△H=+1.9kJ•mol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 简单查看答案及解析
-
下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为37的是( )
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
下列说法错误的是( )
A.CH3OH转变成H2的反应不一定要吸收能量
B.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ
C.反应①中的能量变化如图所示

D.根据反应①和②推知:H2(g)+1/2O2(g)=H2O(g) ΔH=-241.9kJ/mol
难度: 简单查看答案及解析
-
各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
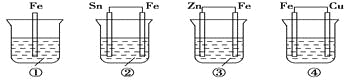
A.④②①③ B.④③①② C.②①③④ D.③②④①
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体置于1 L的密闭容器中,混合后发生如下反应:2A(g) + B(g) = 2C(g)。若经2 s后测得C的浓度为1.2 mol/L,下列说法正确的是( )
A.用物质A表示的反应速率为1.2 mol/(L·s)
B.用物质B表示的反应速率为0.6 mol/(L·s)
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.6 mol/L
难度: 中等查看答案及解析
-
反应4A(g)+3B(g)=2C(g)+D(g),经2min,B的浓度减少0.6 mol•L-1。对此反应速率的表示正确的是( )
①用A表示的反应速率是0.4 mol•L-1•min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2 min末的反应速率,用B表示是0.3 mol•L-1•min-1
④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
A.①②
B.③
C.①
D.②④
难度: 中等查看答案及解析
-
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=+2b kJ/mol
B.C2H2(g)+
O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-b kJ/mol
难度: 简单查看答案及解析
-
一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )
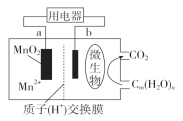
A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-=Mn2++2H2O
难度: 中等查看答案及解析
-
具有下列结构示意图的微粒,既可以是原子又可以是阴离子和阳离子的是 ( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2
Cd+2NiO(OH)+2H2O;由此可知,该电池放电时的负极材料是
A.Cd B.Ni(OH)2 C.Cd(OH)2 D.NiO(OH)
难度: 简单查看答案及解析
-
在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用( )
A.HC1 B.NaOH C.NaCl D.CuSO4
难度: 困难查看答案及解析
-
在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为
A.1.62g B.6.48g C.3.24g D.12.96g
难度: 中等查看答案及解析